Related Articles
- 16 Févr 19Les toxines nous entourent. Que ce soit les gaz de votre voiture, votre diner surgelé ou les pensées négatives au travail, les toxines sont partout.
- 27 Nov 18Depuis quelques décennies, on a vu la communauté médicale et sanitaire recommander au grand public de « boire avec modération ». De récentes découvertes scientifiques rendent pourtant difficile à tout médecin raisonnable de maintenir cette position. Il est peut-être temps pour la communauté médicale d’en finir avec cette recommandation inutile et nocive, et de soutenir la cause de l’abstinence plutôt que celle de la modération.
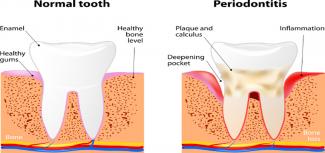
- 21 Mai 18Vous savez, bien sûr, que le nettoyage des dents est bon pour l’hygiène buccale, mais savez-vous qu’il peut aussi améliorer le bien-être de tout l’organisme ? Le brossage et le passage du fil dentaire chaque jour sont indispensables à l’entretien de nos dents et de nos gencives, mais sont peut-être encore plus importants pour la femme enceinte et pour celle qui veut l’être.
- 02 Sept 16
- 03 Mars 14'; $link = url($path, array('absolute' => TRUE)); $nid = arg(1); if ($nid == 201403){ ?> download pdf
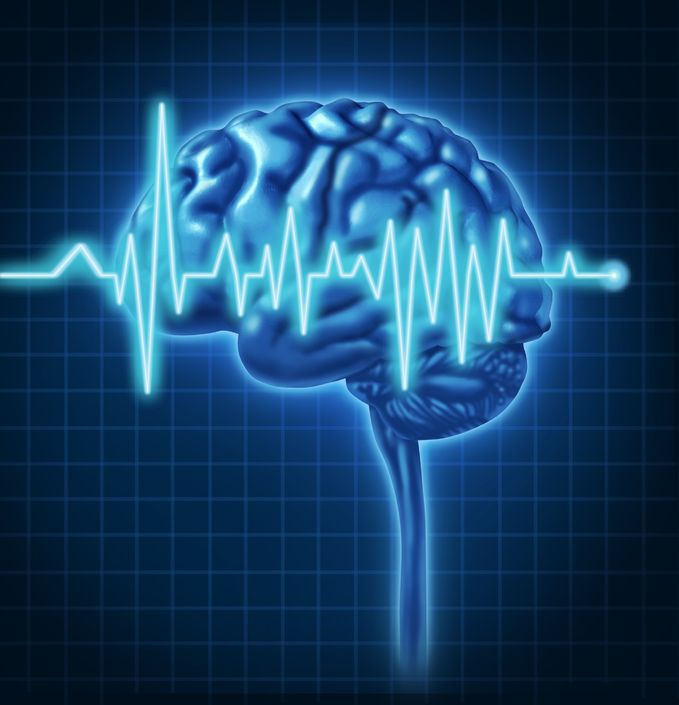
 Depuis plus d’un an, Naturopathic Currents a traité de plusieurs nouveaux agents qui s’avèrent importants pour la santé mentale incluant la vitamine D, la choline et le GABA. Dans cet article, nous nous attarderons sur un nouvel agent d’intérêt : la N-acétylcystéine (NAC). Un éventail de données fait surface suggérant des effets puissants de NAC pour une variété de conditions psychiatriques incluant la dépression, la maladie bipolaire, la dépendance et la schizophrénie.
17 Mars 1706 juil 19Ma fleur est l’une des premières à s’ouvrir au printemps. Sur les pelouses soigneusement entretenues, mon jaune vif et gai se remarque très vite. Je suis partout, et tout le monde me reconnait. Je m’implante sans rien demander à personne et suis bien difficile à éliminer. Vous l’avez sans doute deviné : je suis le pissenlit, l’obstiné pissenlit.17 Mars 1710 Mars 14
Depuis plus d’un an, Naturopathic Currents a traité de plusieurs nouveaux agents qui s’avèrent importants pour la santé mentale incluant la vitamine D, la choline et le GABA. Dans cet article, nous nous attarderons sur un nouvel agent d’intérêt : la N-acétylcystéine (NAC). Un éventail de données fait surface suggérant des effets puissants de NAC pour une variété de conditions psychiatriques incluant la dépression, la maladie bipolaire, la dépendance et la schizophrénie.
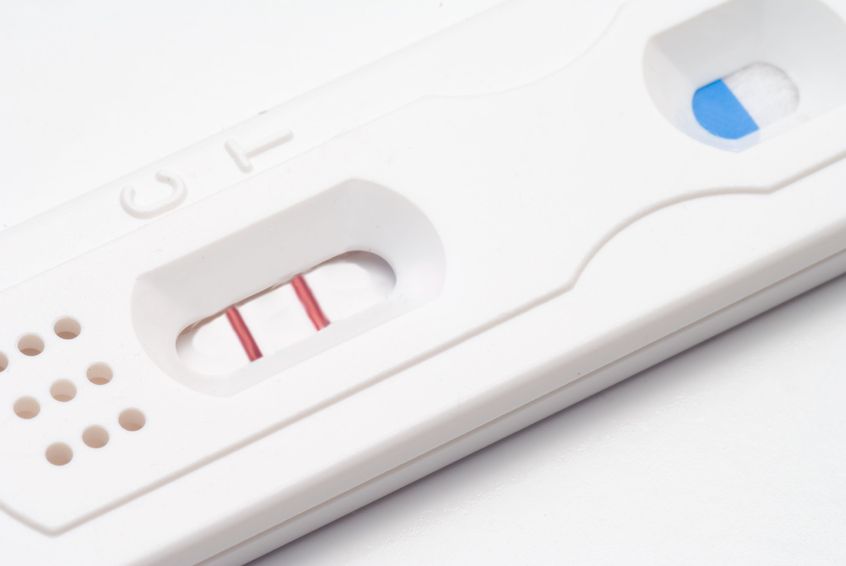
17 Mars 1706 juil 19Ma fleur est l’une des premières à s’ouvrir au printemps. Sur les pelouses soigneusement entretenues, mon jaune vif et gai se remarque très vite. Je suis partout, et tout le monde me reconnait. Je m’implante sans rien demander à personne et suis bien difficile à éliminer. Vous l’avez sans doute deviné : je suis le pissenlit, l’obstiné pissenlit.17 Mars 1710 Mars 14 Le nombre de couples vivant l’infertilité et/ou ayant recours à la technologie de reproduction assistée ne cesse de croitre. (1) Une étude publiée en 2012 stipulait que parmi les couples canadiens (dont la femme est âgée entre 18 et 44 ans), la prévalence d’infertilité se situait entre 11 et 15%, ce qui représente une augmentation par rapport aux données statistiques antérieures.
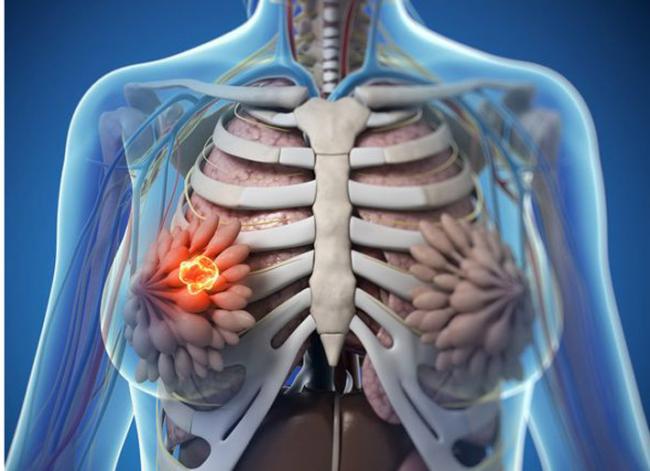
10 juil 1717 juil 1605 Oct 1629 Avr 14Dormir peut être une affaire difficile ! Ceux qui connaissent un sommeil sain et régulier pensent qu’il s’agit du plus simple des phénomènes physiologiques. Pourtant, près de 30% de la population souffre d’insomnie (1), ce qui a des conséquences réelles et importantes sur la santé, en plus d’affecter la qualité de la vie. Même les perturbations de courte durée du sommeil sont associées à des problèmes métaboliques, à l’insensibilité à l’insuline, à une mauvaise régulation glycémique, à l’augmentation de l’indice de masse corporelle (IMC), de la douleur et des inflammations, et même à une plus forte mortalité (2). Quant aux perturbations pathologiques du sommeil, elles peuvent caractériser des troubles psychiatriques (3) et neurodégénératifs (4), ou y contribuer.23 Mai 15La mastite fibrokystique se caractérise par des grosseurs ou des kystes dans la poitrine (1). Elle est provoquée par un excès d’œstrogènes et une carence en progestérone entrainant d’une hyper-prolifération du tissu conjonctif. La maladie peut être asymptomatique, ou provoquer nodules, gonflements et douleurs dans les seins (2,3). La nodularité est cyclique et bilatérale, avec des kystes de taille diverse. La douleur tend à empirer avant les règles, les tissus étant plus sensibles aux œstrogènes dans la période prémenstruelle (2). La maladie progresse avec l’âge et est à son degré le plus élevé chez les femmes autour de la quarantaine. La mastite fibrokystique régresse ensuite, après la ménopause, en raison de la baisse radicale du taux d’œstrogènes (3).24 Sept 14La détoxification de l’organisme peut être réalisée de diverses façons. L’objectif, pour l’essentiel, est d’éliminer les substances chimiques et les polluants environnementaux qui surchargent l’organisme et sont responsables du développement de nombreux problèmes de santé. Une récente étude a révélé que plus de 5 millions de substances chimiques présentes dans l’environnement avaient un impact négatif sur notre système musculaire, neurologique, cardiovasculaire et pulmonaire (1). Les saunas et les lampes à infrarouge sont des dispositifs thérapeutiques efficaces et fiables d’amélioration de la santé globale, grâce à leur capacité à éliminer ces substances chimiques par l’intermédiaire de la peau et de la transpiration.23 Nov 14Le trouble du déficit de l'attention hyperactif (TDAH) est un problème neurologique fréquent, qui concernerait environ 5,29% des enfants dans le monde (1). Une étude néerlandaise a révélé que 70% d’entre eux en seraient toujours affectés à l’âge adulte (2). Parmi les caractéristiques du TDAH, on peut citer un niveau élevé d’inattention, d’impulsivité et d’hyperactivité (3). Le TDAH a été associé à l’obésité et à l’inactivité infantiles (4), aux addictions (5), aux risques de blessures (6), ainsi qu’à des problèmes d’ordre scolaire, professionnel et social (7). Il est donc important de comprendre quels sont les moyens de réduire l’impact négatif du TDAH sur la vie des personnes concernées.03 Févr 1523 Déc 14L’autisme est un trouble neuro-développemental à base biologique, entrant dans la catégorie des troubles envahissants du développement (1). Certains considèrent qu’il s’agit du type de troubles le plus grave du spectre (2). Les troubles du spectre de l’autisme comprennent l’autisme proprement dit, le syndrome d’Asperger, le trouble envahissant du développement (non autrement spécifié), le trouble désintégratif de l’enfance, et le syndrome de Rett (1). Chaque trouble du spectre peut être différencié en fonction de ses symptômes et d'autres traits cliniques. L’autisme se caractérise par des particularités qualitatives et une déficience dans l'interaction sociale et la communication, ainsi que par des intérêts restreints et un comportement rigide et répétitif (3). Les symptômes de l’autisme peuvent ressembler ou survenir en même temps qu’une déficience intellectuelle, un trouble du déficit de l'attention avec hyperactivité et/ou un trouble obsessionnel-compulsif (1).16 Mars 1716 juin 17
Le nombre de couples vivant l’infertilité et/ou ayant recours à la technologie de reproduction assistée ne cesse de croitre. (1) Une étude publiée en 2012 stipulait que parmi les couples canadiens (dont la femme est âgée entre 18 et 44 ans), la prévalence d’infertilité se situait entre 11 et 15%, ce qui représente une augmentation par rapport aux données statistiques antérieures.
10 juil 1717 juil 1605 Oct 1629 Avr 14Dormir peut être une affaire difficile ! Ceux qui connaissent un sommeil sain et régulier pensent qu’il s’agit du plus simple des phénomènes physiologiques. Pourtant, près de 30% de la population souffre d’insomnie (1), ce qui a des conséquences réelles et importantes sur la santé, en plus d’affecter la qualité de la vie. Même les perturbations de courte durée du sommeil sont associées à des problèmes métaboliques, à l’insensibilité à l’insuline, à une mauvaise régulation glycémique, à l’augmentation de l’indice de masse corporelle (IMC), de la douleur et des inflammations, et même à une plus forte mortalité (2). Quant aux perturbations pathologiques du sommeil, elles peuvent caractériser des troubles psychiatriques (3) et neurodégénératifs (4), ou y contribuer.23 Mai 15La mastite fibrokystique se caractérise par des grosseurs ou des kystes dans la poitrine (1). Elle est provoquée par un excès d’œstrogènes et une carence en progestérone entrainant d’une hyper-prolifération du tissu conjonctif. La maladie peut être asymptomatique, ou provoquer nodules, gonflements et douleurs dans les seins (2,3). La nodularité est cyclique et bilatérale, avec des kystes de taille diverse. La douleur tend à empirer avant les règles, les tissus étant plus sensibles aux œstrogènes dans la période prémenstruelle (2). La maladie progresse avec l’âge et est à son degré le plus élevé chez les femmes autour de la quarantaine. La mastite fibrokystique régresse ensuite, après la ménopause, en raison de la baisse radicale du taux d’œstrogènes (3).24 Sept 14La détoxification de l’organisme peut être réalisée de diverses façons. L’objectif, pour l’essentiel, est d’éliminer les substances chimiques et les polluants environnementaux qui surchargent l’organisme et sont responsables du développement de nombreux problèmes de santé. Une récente étude a révélé que plus de 5 millions de substances chimiques présentes dans l’environnement avaient un impact négatif sur notre système musculaire, neurologique, cardiovasculaire et pulmonaire (1). Les saunas et les lampes à infrarouge sont des dispositifs thérapeutiques efficaces et fiables d’amélioration de la santé globale, grâce à leur capacité à éliminer ces substances chimiques par l’intermédiaire de la peau et de la transpiration.23 Nov 14Le trouble du déficit de l'attention hyperactif (TDAH) est un problème neurologique fréquent, qui concernerait environ 5,29% des enfants dans le monde (1). Une étude néerlandaise a révélé que 70% d’entre eux en seraient toujours affectés à l’âge adulte (2). Parmi les caractéristiques du TDAH, on peut citer un niveau élevé d’inattention, d’impulsivité et d’hyperactivité (3). Le TDAH a été associé à l’obésité et à l’inactivité infantiles (4), aux addictions (5), aux risques de blessures (6), ainsi qu’à des problèmes d’ordre scolaire, professionnel et social (7). Il est donc important de comprendre quels sont les moyens de réduire l’impact négatif du TDAH sur la vie des personnes concernées.03 Févr 1523 Déc 14L’autisme est un trouble neuro-développemental à base biologique, entrant dans la catégorie des troubles envahissants du développement (1). Certains considèrent qu’il s’agit du type de troubles le plus grave du spectre (2). Les troubles du spectre de l’autisme comprennent l’autisme proprement dit, le syndrome d’Asperger, le trouble envahissant du développement (non autrement spécifié), le trouble désintégratif de l’enfance, et le syndrome de Rett (1). Chaque trouble du spectre peut être différencié en fonction de ses symptômes et d'autres traits cliniques. L’autisme se caractérise par des particularités qualitatives et une déficience dans l'interaction sociale et la communication, ainsi que par des intérêts restreints et un comportement rigide et répétitif (3). Les symptômes de l’autisme peuvent ressembler ou survenir en même temps qu’une déficience intellectuelle, un trouble du déficit de l'attention avec hyperactivité et/ou un trouble obsessionnel-compulsif (1).16 Mars 1716 juin 17 Alors que la température commence à remonter et que la neige commence à disparaître, les jours s'allongent et un sentiment printanier grandit. Le retour du printemps apporte souvent une impression de nouveaux commencements, de nouvelle croissance, de nouveau départ. Pour beaucoup, c'est aussi le moment de faire un grand nettoyage de printemps : faire la tornade blanche dans toute la maison.
Alors que la température commence à remonter et que la neige commence à disparaître, les jours s'allongent et un sentiment printanier grandit. Le retour du printemps apporte souvent une impression de nouveaux commencements, de nouvelle croissance, de nouveau départ. Pour beaucoup, c'est aussi le moment de faire un grand nettoyage de printemps : faire la tornade blanche dans toute la maison.
Actualités
Votre abonnement n'a pas pu être enregistré. Veuillez réessayer.
Vous vous êtes abonné avec succès à l’infolettre de Naturopathic Currents.
Les plus populaires
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13