Related Articles
- 01 Oct 13
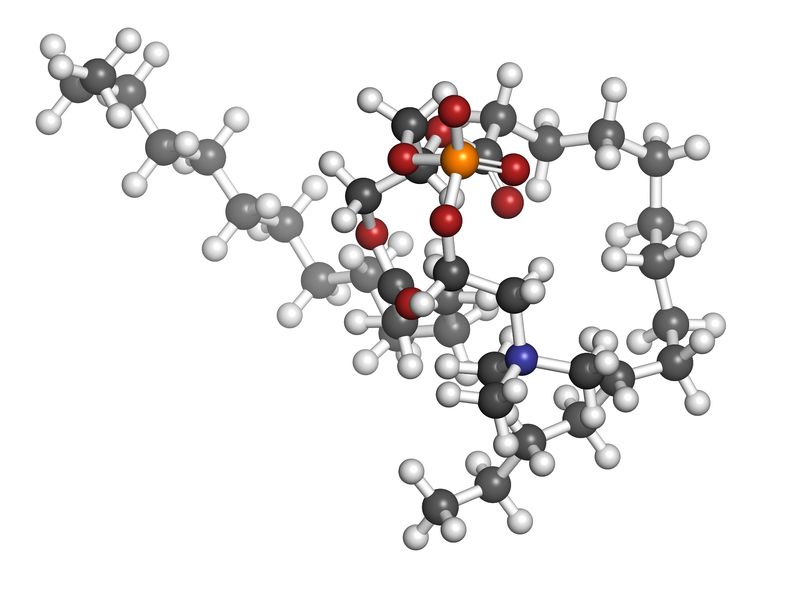
 La phosphatidylcholine est un nutriment fascinant ayant un éventail impressionnant de fonctions peu connues pour la santé des humains. La phosphatidylcholine est un phospholipide essentiel servant de composant important à la membrane cellulaire composée de bicouches lipidiques. Elle est également une source de choline importante représentant 95% des réserves de choline dans les tissus.21 Mai 18Le magnésium est le quatrième minéral le plus abondant dans le corps humain,[1] et il est essentiel à plusieurs centaines de réactions métaboliques et hormonales, chaque jour.[2] Il participe à la formation osseuse (avec le calcium) et ses propriétés myorelaxantes naturelles favorisant le sommeil en font l'objet d'un intérêt croissant. Mais ce n'est qu'un aperçu des bienfaits du magnésium. Il est nécessaire pour le fonctionnement normal des nerfs et des muscles, le rythme cardiaque et la santé du système immunitaire.10 Août 17
La phosphatidylcholine est un nutriment fascinant ayant un éventail impressionnant de fonctions peu connues pour la santé des humains. La phosphatidylcholine est un phospholipide essentiel servant de composant important à la membrane cellulaire composée de bicouches lipidiques. Elle est également une source de choline importante représentant 95% des réserves de choline dans les tissus.21 Mai 18Le magnésium est le quatrième minéral le plus abondant dans le corps humain,[1] et il est essentiel à plusieurs centaines de réactions métaboliques et hormonales, chaque jour.[2] Il participe à la formation osseuse (avec le calcium) et ses propriétés myorelaxantes naturelles favorisant le sommeil en font l'objet d'un intérêt croissant. Mais ce n'est qu'un aperçu des bienfaits du magnésium. Il est nécessaire pour le fonctionnement normal des nerfs et des muscles, le rythme cardiaque et la santé du système immunitaire.10 Août 17 Des millions de personnes souffrent de douleur chronique, sous une forme ou une autre. Que la cause soit une blessure, une maladie ou une anomalie génétique, la douleur chronique affecte la qualité de vie. Quand la douleur limite votre aptitude à faire quelque chose, ou vous empêche de faire quelque chose, il y a aussi un effet psychologique.03 Nov 1610 juil 17
Des millions de personnes souffrent de douleur chronique, sous une forme ou une autre. Que la cause soit une blessure, une maladie ou une anomalie génétique, la douleur chronique affecte la qualité de vie. Quand la douleur limite votre aptitude à faire quelque chose, ou vous empêche de faire quelque chose, il y a aussi un effet psychologique.03 Nov 1610 juil 17 La maladie de Parkinson touche entre 1 et 2% des personnes de plus de 65 ans et devient un problème croissant, car les baby boomers vieillissent. Cette pathologie se caractérise par des anomalies de démarche, une rigidité musculaire et un mouvement ralenti, on constate typiquement une difficulté à marcher ou à se lever d'une chaise. La maladie de Parkinson est un trouble du mouvement neurodégénératif et elle a des antécédents compliqués en termes de physiopathologie et de cause.23 juil 15La cryothérapie corps entier (CCE) est un traitement sanitaire impliquant de courtes expositions à des températures ambiantes inférieures à −100°C (1). Une séance de CCE dure environ 2 à 5 minutes, et la fréquence des séances peut varier suivant le but recherché. Le patient prend place dans une petite cabine qui émet une brume sèche et froide tirée d’un container d’azote liquide situé à proximité. Il en résulte une baisse spectaculaire, quoique brève, des températures corporelles.03 Janv 14
La maladie de Parkinson touche entre 1 et 2% des personnes de plus de 65 ans et devient un problème croissant, car les baby boomers vieillissent. Cette pathologie se caractérise par des anomalies de démarche, une rigidité musculaire et un mouvement ralenti, on constate typiquement une difficulté à marcher ou à se lever d'une chaise. La maladie de Parkinson est un trouble du mouvement neurodégénératif et elle a des antécédents compliqués en termes de physiopathologie et de cause.23 juil 15La cryothérapie corps entier (CCE) est un traitement sanitaire impliquant de courtes expositions à des températures ambiantes inférieures à −100°C (1). Une séance de CCE dure environ 2 à 5 minutes, et la fréquence des séances peut varier suivant le but recherché. Le patient prend place dans une petite cabine qui émet une brume sèche et froide tirée d’un container d’azote liquide situé à proximité. Il en résulte une baisse spectaculaire, quoique brève, des températures corporelles.03 Janv 14 Le syndrome de la fibromyalgie (SFM) est une condition caractérisée par des douleurs chroniques répandues à travers le corps et par une fatigue extrême. Depuis bien longtemps, on lui considère un diagnostic controversé principalement à cause que sa pathophysiologie qui est peu comprise. Certains croyaient qu’il s’agissait de simulation ou d’une condition psychosomatique (2), d’autres l’ont vu telle une maladie rhumatologique ou neurologique23 juin 15La niacine est l’une des formes de la vitamine B3. La nicotinamide et l’inositol hexanicotinate sont les deux autres formes de cette vitamine, souvent utilisée à des fins thérapeutiques. Les vitamines B aident l’organisme à utiliser les graisses et les protéines, ainsi qu’à convertir la nourriture en combustible pour produire de l’énergie (1). Elles sont hydrosolubles par nature – la niacine peut donc être facilement assimilée quand elle est prise avec de l’eau ou dissoute dans l’eau (2). Les sources alimentaires de la niacine sont notamment les œufs, le son, l’arachide, la viande, la volaille, le poisson, les légumineuses, les graines, les céréales et la levure. Les besoins en vitamine B3 de la plupart des personnes sont couverts par l’alimentation (3).24 Nov 14La S-adénosylméthionine (SAMe) est une molécule largement répandue dans l’organisme, et dont le rôle est crucial pour un certain nombre de réactions biochimiques. La SAMe a d’abord attiré l’attention des scientifiques dans les années 1970, et a été utilisée en Europe depuis cette époque comme antidépresseur (1). Elle n’est pourtant devenue disponible en Amérique du Nord que depuis une quinzaine d’années. Au plan biochimique, la SAMe fonctionne comme un donneur du groupe méthyle, et agit selon le même processus que l'acide folique et la vitamine B12. L’aspect le plus notable de ce processus est le cycle de l'homocystéine, qui recycle l'homocystéine en méthionine, par l’utilisation de l'acide folique, de la vitamine B12 et de la SAMe. L’homocystéine étant un marqueur bien connu du risque cardiovasculaire, la SAMe peut être essentielle pour réduire le risque de troubles cardiaques et d’accident vasculaire cérébral (AVC). La SAMe est également nécessaire à la synthèse de la créatine, de la carnitine, et d’importants neurotransmetteurs cérébraux (1). Bien que la SAMe présente aussi un intérêt pour diverses affections telles que la fibromyalgie, l’arthrose et les troubles hépatiques, nous nous intéresserons principalement à ses effets sur la santé mentale et sur les troubles de l’humeur.10 Févr 14
Le syndrome de la fibromyalgie (SFM) est une condition caractérisée par des douleurs chroniques répandues à travers le corps et par une fatigue extrême. Depuis bien longtemps, on lui considère un diagnostic controversé principalement à cause que sa pathophysiologie qui est peu comprise. Certains croyaient qu’il s’agissait de simulation ou d’une condition psychosomatique (2), d’autres l’ont vu telle une maladie rhumatologique ou neurologique23 juin 15La niacine est l’une des formes de la vitamine B3. La nicotinamide et l’inositol hexanicotinate sont les deux autres formes de cette vitamine, souvent utilisée à des fins thérapeutiques. Les vitamines B aident l’organisme à utiliser les graisses et les protéines, ainsi qu’à convertir la nourriture en combustible pour produire de l’énergie (1). Elles sont hydrosolubles par nature – la niacine peut donc être facilement assimilée quand elle est prise avec de l’eau ou dissoute dans l’eau (2). Les sources alimentaires de la niacine sont notamment les œufs, le son, l’arachide, la viande, la volaille, le poisson, les légumineuses, les graines, les céréales et la levure. Les besoins en vitamine B3 de la plupart des personnes sont couverts par l’alimentation (3).24 Nov 14La S-adénosylméthionine (SAMe) est une molécule largement répandue dans l’organisme, et dont le rôle est crucial pour un certain nombre de réactions biochimiques. La SAMe a d’abord attiré l’attention des scientifiques dans les années 1970, et a été utilisée en Europe depuis cette époque comme antidépresseur (1). Elle n’est pourtant devenue disponible en Amérique du Nord que depuis une quinzaine d’années. Au plan biochimique, la SAMe fonctionne comme un donneur du groupe méthyle, et agit selon le même processus que l'acide folique et la vitamine B12. L’aspect le plus notable de ce processus est le cycle de l'homocystéine, qui recycle l'homocystéine en méthionine, par l’utilisation de l'acide folique, de la vitamine B12 et de la SAMe. L’homocystéine étant un marqueur bien connu du risque cardiovasculaire, la SAMe peut être essentielle pour réduire le risque de troubles cardiaques et d’accident vasculaire cérébral (AVC). La SAMe est également nécessaire à la synthèse de la créatine, de la carnitine, et d’importants neurotransmetteurs cérébraux (1). Bien que la SAMe présente aussi un intérêt pour diverses affections telles que la fibromyalgie, l’arthrose et les troubles hépatiques, nous nous intéresserons principalement à ses effets sur la santé mentale et sur les troubles de l’humeur.10 Févr 14 Le déclin cognitif est de plus en plus prévalent, indiquant ainsi le besoin d’interventions durables au mode de vie afin de soutenir, de maintenir et d’améliorer la santé cognitive. Tout comme l’activité physique améliore la santé du corps, le mental a lui aussi besoin d’entrainement. L’évolution de la technologie offre des solutions nouvelles et prometteuses pour l’entrainement cognitif. Une de ces solutions est le monde de la réalité virtuelle, des jeux vidéo et des dispositifs mobiles qui permettent le développement de certains programmes d’entrainement personnalisés, crées spécialement pour répondre aux besoins de chacun.03 Janv 14
Le déclin cognitif est de plus en plus prévalent, indiquant ainsi le besoin d’interventions durables au mode de vie afin de soutenir, de maintenir et d’améliorer la santé cognitive. Tout comme l’activité physique améliore la santé du corps, le mental a lui aussi besoin d’entrainement. L’évolution de la technologie offre des solutions nouvelles et prometteuses pour l’entrainement cognitif. Une de ces solutions est le monde de la réalité virtuelle, des jeux vidéo et des dispositifs mobiles qui permettent le développement de certains programmes d’entrainement personnalisés, crées spécialement pour répondre aux besoins de chacun.03 Janv 14 La vitamine D3, aussi connue sous le nom de cholécalciférol ou la « vitamine du soleil » est un nutriment en pleine émergence offrant un éventail de rôles thérapeutiques potentiels. En plus d’être bien reconnue pour son rôle dans la santé osseuse, la vitamine D est analysée comme agent important dans la modulation de la fonction immunitaire, des émotions et des fonctions cognitives ainsi que pour son impact sur les facteurs de risque cardiovasculaire et ses effets protecteurs contre le développement du cancer .
17 juin 13
La vitamine D3, aussi connue sous le nom de cholécalciférol ou la « vitamine du soleil » est un nutriment en pleine émergence offrant un éventail de rôles thérapeutiques potentiels. En plus d’être bien reconnue pour son rôle dans la santé osseuse, la vitamine D est analysée comme agent important dans la modulation de la fonction immunitaire, des émotions et des fonctions cognitives ainsi que pour son impact sur les facteurs de risque cardiovasculaire et ses effets protecteurs contre le développement du cancer .
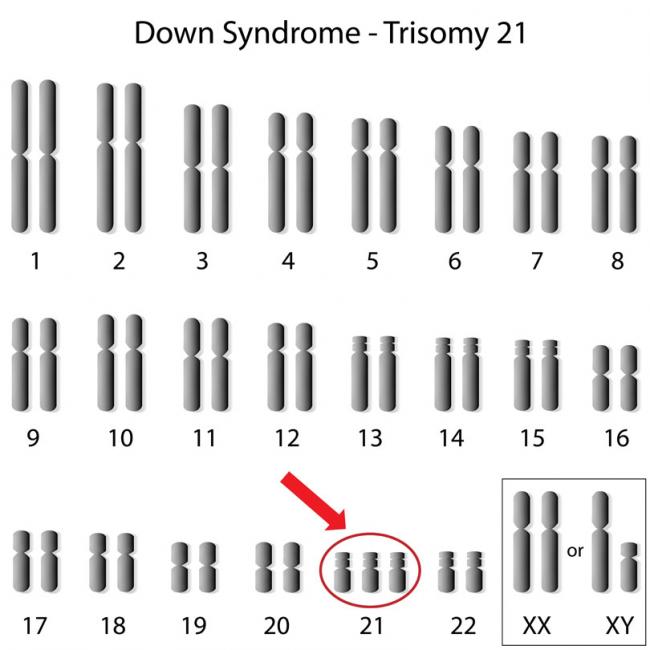
17 juin 13 Les minéraux sont des éléments chimiques qui apportent structure et régularisation de l’environnement interne des organismes vivants. Bien qu’ils ne correspondent qu’à une minime fraction du corps, soit seulement 4% du poids total du corps, leur importance est manifestement sous-évaluée. En effet, la vie humaine serait impossible sans eux.18 Mai 16Le syndrome de Down doit son nom à John Langdon Down qui a, le premier, décrit cette pathologie en 1866. Le syndrome de Down a reçu plus récemment l’appellation de trisomie 21 (T21), qui se réfère au 21e chromosome surnuméraire qui distingue 95% des personnes atteintes de cette affection. La T21 est plus répandue que ce que la plupart des gens supposent. On estime que par le monde un enfant sur 800 nait atteint de T21.25 Févr 16Le syndrome des jambes sans repos (SJSR) est une affection qui touche une partie du système nerveux, provoquant une envie urgente de remuer les jambes. Ce syndrome, qui interfère avec le sommeil, peut aussi être considéré comme un trouble du sommeil. Selon l’intensité des symptômes, le SJSR peut se révéler assez perturbant.08 Janv 15
Les minéraux sont des éléments chimiques qui apportent structure et régularisation de l’environnement interne des organismes vivants. Bien qu’ils ne correspondent qu’à une minime fraction du corps, soit seulement 4% du poids total du corps, leur importance est manifestement sous-évaluée. En effet, la vie humaine serait impossible sans eux.18 Mai 16Le syndrome de Down doit son nom à John Langdon Down qui a, le premier, décrit cette pathologie en 1866. Le syndrome de Down a reçu plus récemment l’appellation de trisomie 21 (T21), qui se réfère au 21e chromosome surnuméraire qui distingue 95% des personnes atteintes de cette affection. La T21 est plus répandue que ce que la plupart des gens supposent. On estime que par le monde un enfant sur 800 nait atteint de T21.25 Févr 16Le syndrome des jambes sans repos (SJSR) est une affection qui touche une partie du système nerveux, provoquant une envie urgente de remuer les jambes. Ce syndrome, qui interfère avec le sommeil, peut aussi être considéré comme un trouble du sommeil. Selon l’intensité des symptômes, le SJSR peut se révéler assez perturbant.08 Janv 15 Le vertige est la sensation du mouvement dans son environnement lorsqu’en effet, aucun mouvement n’a lieu. Les symptômes incluent le sentiment de débalancement ou la sensation que la pièce dans laquelle nous nous trouvons tourne. Lorsque cette condition est sévère, elle peut être accompagnée par la nausée et les vomissements ainsi que par un risque accru de chute.08 Janv 15
Le vertige est la sensation du mouvement dans son environnement lorsqu’en effet, aucun mouvement n’a lieu. Les symptômes incluent le sentiment de débalancement ou la sensation que la pièce dans laquelle nous nous trouvons tourne. Lorsque cette condition est sévère, elle peut être accompagnée par la nausée et les vomissements ainsi que par un risque accru de chute.08 Janv 15 Les acouphènes décrivent les « bourdonnements dans les oreilles » du point de vue médical. Un acouphène est défini par une perception consciente d’une sensation auditive lors de l’absence d’un stimulus externe. Il s’agit d’un symptôme plutôt commun pouvant être très persistant et ayant donc un effet dérangeant sur les activités quotidiennes et sur la qualité de la vie.17 juin 16
Les acouphènes décrivent les « bourdonnements dans les oreilles » du point de vue médical. Un acouphène est défini par une perception consciente d’une sensation auditive lors de l’absence d’un stimulus externe. Il s’agit d’un symptôme plutôt commun pouvant être très persistant et ayant donc un effet dérangeant sur les activités quotidiennes et sur la qualité de la vie.17 juin 16 L’usage des médecines complémentaires pour le traitement du cancer et ses effets secondaires est monté en flèche ces dernières années. Les thérapies complémentaires, de nature non pharmaceutique, améliorent la qualité de vie et réduisent les effets secondaires des thérapies conventionnelles. Elles comprennent le massage, le yoga, la méditation, l’acuponcture, la supplémentation nutritionnelle et les thérapies intraveineuses.23 juin 15Les maux de tête sont pénibles à supporter et, selon leur gravité, peuvent nous gêner dans l’exécution de nos tâches quotidiennes. Il existe de nombreux types de maux de tête, dont les plus courants sont la céphalée de tension, l’algie vasculaire de la face (AVF) et la migraine. Dans la céphalée de tension, la douleur commence à l’arrière de la tête et dans le haut du cou, qui semblent tous deux pris dans un étau, et peut se propager jusqu’à encercler toute le crâne. Il s’agit là de la forme la plus simple de mal de tête, permettant généralement à la plupart des gens de vivre normalement. Ce qui provoque une céphalée de tension ? On ne le sait toujours pas précisément (1). En général, les muscles du crâne se contractent et, quand ils sont en surtension, peuvent être atteints d’une inflammation ou de spasmes. C’est ce qui provoque la douleur. La tension excessive de ces muscles peut provenir de facteurs de stress physique ou mental.16 Avr 17
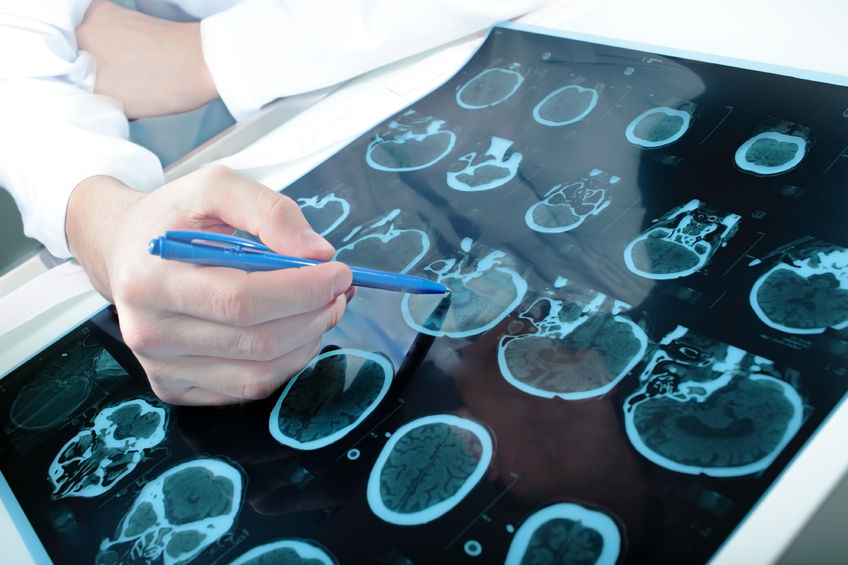
L’usage des médecines complémentaires pour le traitement du cancer et ses effets secondaires est monté en flèche ces dernières années. Les thérapies complémentaires, de nature non pharmaceutique, améliorent la qualité de vie et réduisent les effets secondaires des thérapies conventionnelles. Elles comprennent le massage, le yoga, la méditation, l’acuponcture, la supplémentation nutritionnelle et les thérapies intraveineuses.23 juin 15Les maux de tête sont pénibles à supporter et, selon leur gravité, peuvent nous gêner dans l’exécution de nos tâches quotidiennes. Il existe de nombreux types de maux de tête, dont les plus courants sont la céphalée de tension, l’algie vasculaire de la face (AVF) et la migraine. Dans la céphalée de tension, la douleur commence à l’arrière de la tête et dans le haut du cou, qui semblent tous deux pris dans un étau, et peut se propager jusqu’à encercler toute le crâne. Il s’agit là de la forme la plus simple de mal de tête, permettant généralement à la plupart des gens de vivre normalement. Ce qui provoque une céphalée de tension ? On ne le sait toujours pas précisément (1). En général, les muscles du crâne se contractent et, quand ils sont en surtension, peuvent être atteints d’une inflammation ou de spasmes. C’est ce qui provoque la douleur. La tension excessive de ces muscles peut provenir de facteurs de stress physique ou mental.16 Avr 17 La maladie de Parkinson (MdP) est l’un des troubles neurodégénératifs les plus courants, touchant entre 1 et 2% de la population au-dessus de 65 ans. Elle présente, parmi d’autres, les symptômes moteurs suivants : tremblement au repos ; difficultés à marcher, à s’asseoir, à se relever, à se retourner ; raideur musculaire ; modifications dans l’expression du visage ; écriture manuscrite plus petite. 29 Mai 14La maladie d'Alzheimer est une maladie du cerveau évolutive qui grignote lentement la mémoire et perturbe la réflexion. Quand la dégénération progresse, elle peut conduire à l'incapacité d'accomplir des tâches simples. Les symptômes apparaissent typiquement après 60 ans. La maladie d'Alzheimer est considérée comme la cause la plus courante de démence - la perte du fonctionnement cognitif et la perte de certains fonctionnements comportementaux (1). Les scientifiques et les chercheurs pensent que la progression de la maladie implique le dépôt de plaques dans le cerveau. Ces plaques empêchent alors les neurones de fonctionner normalement, puis finissent par causer leur mort. La maladie d'Alzheimer est habituellement diagnostiquée à partir d'antécédents cliniques et de l'observation du comportement. Certains outils d'imagerie peuvent aussi être utilisés, comme le scanner (CT scan) ou l'IRM, mais ils ne seront peut-être efficaces que pour les stades avancés de la maladie.
La maladie de Parkinson (MdP) est l’un des troubles neurodégénératifs les plus courants, touchant entre 1 et 2% de la population au-dessus de 65 ans. Elle présente, parmi d’autres, les symptômes moteurs suivants : tremblement au repos ; difficultés à marcher, à s’asseoir, à se relever, à se retourner ; raideur musculaire ; modifications dans l’expression du visage ; écriture manuscrite plus petite. 29 Mai 14La maladie d'Alzheimer est une maladie du cerveau évolutive qui grignote lentement la mémoire et perturbe la réflexion. Quand la dégénération progresse, elle peut conduire à l'incapacité d'accomplir des tâches simples. Les symptômes apparaissent typiquement après 60 ans. La maladie d'Alzheimer est considérée comme la cause la plus courante de démence - la perte du fonctionnement cognitif et la perte de certains fonctionnements comportementaux (1). Les scientifiques et les chercheurs pensent que la progression de la maladie implique le dépôt de plaques dans le cerveau. Ces plaques empêchent alors les neurones de fonctionner normalement, puis finissent par causer leur mort. La maladie d'Alzheimer est habituellement diagnostiquée à partir d'antécédents cliniques et de l'observation du comportement. Certains outils d'imagerie peuvent aussi être utilisés, comme le scanner (CT scan) ou l'IRM, mais ils ne seront peut-être efficaces que pour les stades avancés de la maladie.
Actualités
Votre abonnement n'a pas pu être enregistré. Veuillez réessayer.
Vous vous êtes abonné avec succès à l’infolettre de Naturopathic Currents.
Les plus populaires
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13