Related Articles
- 10 juil 17
 L'urticaire se traduit par une réaction cutanée qui cause des papules blanches qui démangent. Leur taille est variable et leur apparition dépend de la progression de la réaction (1). Elles sont souvent de forme circulaire ou ovale. Si l'urticaire apparaît de manière chronique, on parle alors d'urticaire chronique. Cela indique habituellement que les papules persistent plus de six semaines, ou qu'elles reviennent régulièrement. Dans cet article, ces réactions cutanées seront appelées simplement urticaire.
L'urticaire se traduit par une réaction cutanée qui cause des papules blanches qui démangent. Leur taille est variable et leur apparition dépend de la progression de la réaction (1). Elles sont souvent de forme circulaire ou ovale. Si l'urticaire apparaît de manière chronique, on parle alors d'urticaire chronique. Cela indique habituellement que les papules persistent plus de six semaines, ou qu'elles reviennent régulièrement. Dans cet article, ces réactions cutanées seront appelées simplement urticaire.
- 06 Déc 18Vous sentez-vous parfois ballonné ou constipé ? Peut-être éprouvez-vous des maux de tête, ou des réactions cutanées, sans raison apparente ? Êtes-vous en permanence fatigué, incapable de vous concentrer ? L’origine de ces réactions pourrait bien vous surprendre, et est peut-être à chercher dans votre assiette.
- 23 juil 18Beaucoup de patients viennent me consulter pour des maladies qui affectent leur qualité de vie mais pour lesquelles il n’existe que peu ou pas de solution « standard ». Des symptômes tels qu’une fatigue qui s’aggrave progressivement, une prise de poids, des éruptions cutanées, des maux de tête et des douleurs articulaires sont fréquents. Ces symptômes restent souvent inexpliqués par la médecine conventionnelle pour ce qui est de leur origine, et ne sont pas pris en charge, ou ne le sont que de façon insuffisante, par les traitements pharmaceutiques. Bien que ces traitements soient essentiels dans de nombreuses circonstances, ils ne sont trop souvent, pour ces symptômes chroniques, pas la meilleure solution.
- 30 Nov 18L’inflammation est devenue un sujet d’actualité pour le monde médical, faisant l’objet de recherches croissantes. On pensait naguère que l’arthrite et l’inflammation articulaire commençaient et finissaient dans les articulations, sans autres influences ni connexions. Nous savons aujourd’hui qu’une inflammation intestinale peut avoir des effets sur l’inflammation articulaire, augmenter le risque de diabète, provoquer des poussées d’eczéma, et même déclencher anxiété et dépression dans le cerveau [1]. Les choses sont donc un peu plus complexes qu’on ne le supposait, et prennent nettement plus de temps à corriger, mais le savoir c’est le pouvoir, et la prise de conscience est la première étape vers le progrès.
- 16 Janv 19Une bonne partie des personnes qui consultent un médecin naturopathe le font principalement pour des problèmes digestifs. Après des mois d’examens et d’analyses, leur médecin conventionnel les a laissées sans réponse claire, et elles sont à la recherche d’un nouveau point de vue. D’autres fois, leurs examens d’imagerie révèlent quelque chose d’important, mais le système médical est malgré tout à court d’options thérapeutiques.
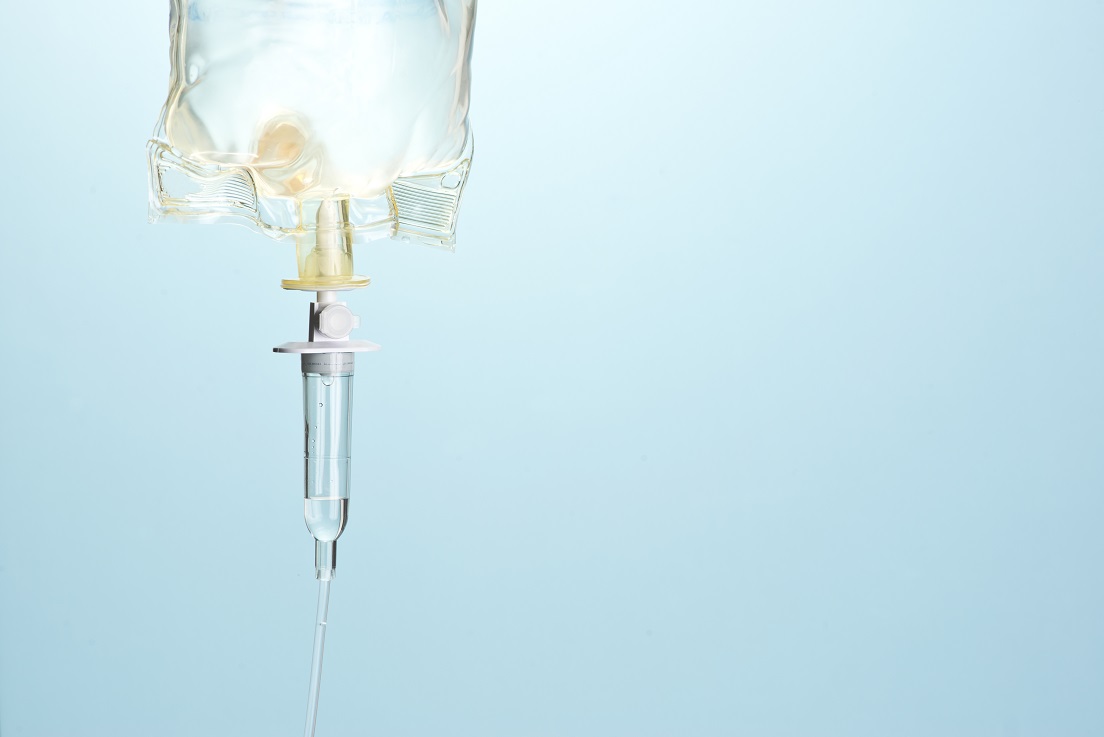
- 24 Sept 18Parlons un peu des thérapies nutritionnelles par injection intraveineuse, une option généralement sous-estimée pour traiter de nombreuses affections chroniques. Bien menée, une thérapie nutritionnelle par injection est sans risque, économique, et peut se révéler étonnamment efficace dans certains cas des plus tenaces.
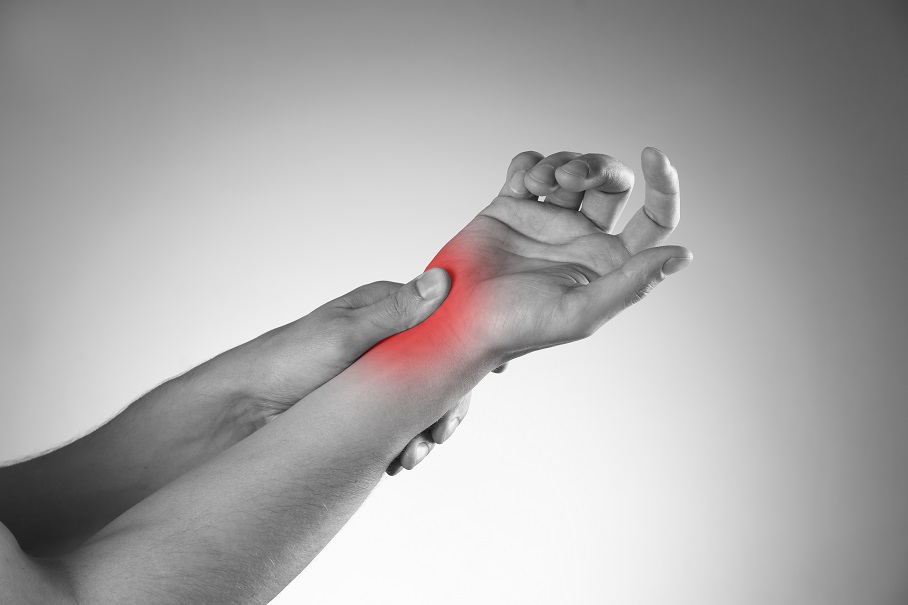
- 16 Févr 19La douleur chronique constitue un problème de santé important, et l’on estime que la moitié des personnes atteintes de douleur chronique en souffrent depuis plus de 10 ans [1]. Environ 52,5 millions de Nord-Américains ont reçu un diagnostic de troubles arthritiques [2], des affections généralement traitées avec des anti-inflammatoires non-stéroïdiens (AINS). Ces médicaments agissent en inhibant des molécules pro-inflammatoires appelées cytokines, notamment l’interleukine IL-6, le facteur de nécrose tumorale alpha (TNFα), et les prostaglandines [3]. Il est bien connu que l’utilisation prolongée d’AINS comme l’ibuprofène et le paracétamol entraine des effets secondaires tels qu’ulcères, hémorragie gastro-intestinale, brûlures d’estomac, ballonnements et gaz [4]. On sait également que les AINS contribuent à l’hyperperméabilité du tube digestif, appelée aussi « syndrome de l’intestin perméable » [5]. Ces facteurs peuvent entrainer le développement d’allergies, d’une colonisation bactérienne chronique de l’intestin grêle, du syndrome du côlon irritable (SCI), entre autres troubles digestifs.
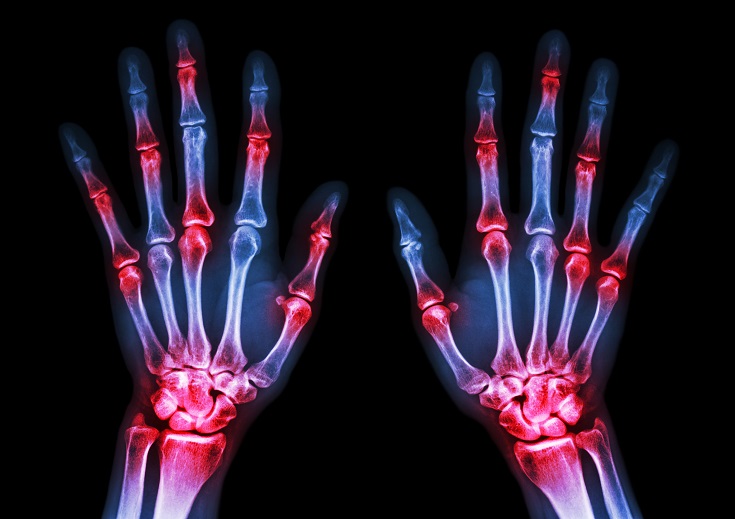
- 16 Janv 19Le mot « arthrite » signifie « inflammation articulaire », du grec ἄρθρον (árthron, « articulation ») et -ῖτις (-îtis, « relatif à ») . Une erreur courante consiste à croire que l’arthrite désigne une maladie précise, alors qu’elle concerne toute douleur ou trouble articulaires. L’arthrite désigne en réalité plus de 100 affections différentes, allant de formes assez légères de tendinites à des pathologies plus systémiques, telles que la polyarthrite rhumatoïde. Elle inclut également les syndromes douloureux et affections liés à l’arthrite, telles que la fibromyalgie et le lupus érythémateux disséminé, qui impliquent le corps entier [1].
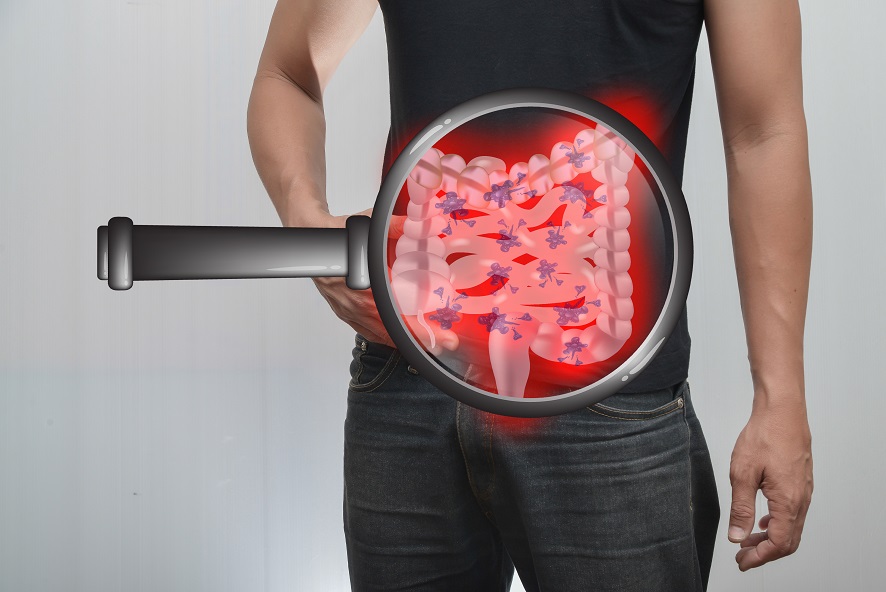
- 16 Févr 19L’état de nos intestins est une part essentielle de notre santé globale. De nombreux problèmes de santé et maladies viennent aujourd’hui d’un déséquilibre intestinal. Notre alimentation, le stress que nous pouvons éprouver, ainsi que notre exposition aux agents toxiques sont à la source d’une dysbiose intestinale, qui affecte notre humeur, notre vitalité et notre énergie. Nous attaquons la journée avec moins d’entrain, et notre quotidien devient plus une corvée qu’autre chose.
- 22 Avr 18Il y a cent ans, l'idée d'être "sensible" à un aliment aurait paru absurde. Ne serait-ce qu'il y a dix ans, les termes "sans gluten" et "allergie aux produits laitiers" étaient rares et la plupart des gens jugeaient sans savoir ce qu'ils signifiaient ou pourquoi c'était important. Aujourd'hui, la plupart des écoles sont des établissements sans fruits à coque, et des lois sont passées pour garantir une description claire de tous les ingrédients d'un produit sur l'emballage.
- 22 Avr 18Le corps humain est une chose fragile, il est exposé aux blessures graves et à la dégénération chronique due au vieillissement. En médecine, certaines choses que nous faisons peuvent participer à la guérison d'une blessure, comme la désinfecter, la panser, soutenir un os cassé avec une attelle, soulager la pression sur un genou douloureux en utilisant une béquille, etc. Mises à part ces stratégies de soutien de base, nous pouvons parfois faire plus qu'attendre que le corps guérisse de lui-même.
- 07 Mai 15
- 06 juil 19Ma fleur est l’une des premières à s’ouvrir au printemps. Sur les pelouses soigneusement entretenues, mon jaune vif et gai se remarque très vite. Je suis partout, et tout le monde me reconnait. Je m’implante sans rien demander à personne et suis bien difficile à éliminer. Vous l’avez sans doute deviné : je suis le pissenlit, l’obstiné pissenlit.
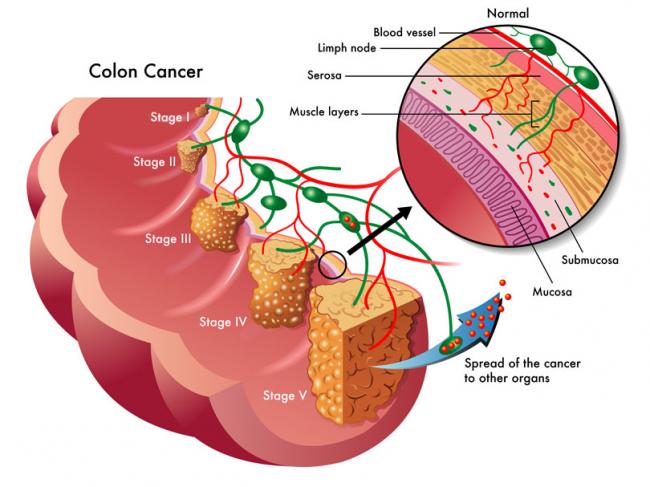
- 18 Avr 16En 2015, 1 homme sur 14 et 1 femme sur 16 ont été diagnostiqués comme souffrant d’un cancer colorectal. Il s’agit de la deuxième cause de décès par cancer pour les hommes, avec 1 chance sur 29 d’en mourir, et de la troisième cause de décès par cancer pour les femmes.
- 18 Mai 16Qu’elle soit naturelle, déclenchée, ou par césarienne, la naissance d’un enfant peut être une expérience passionnante, effrayante et difficile – alors que la vie commence à peine ! Si certains accouchements se déroulent exactement comme prévu, d’autres se révèlent plus délicats, et il est heureux que des interventions telles que l’accouchement par césarienne existent pour éviter à certaines femmes les conséquences négatives d’un accouchement problématique.
- 29 Avr 14Les allergies saisonnières, dont la rhinite allergique, toucheraient jusqu’à 20 % de la population (1). Les allergies sont la première cause d’absentéisme et de sous-activité, aussi bien chez les enfants que chez les adultes. La prévalence de l’allergie commence dans la petite enfance, culmine au moment de l’enfance et de l’adolescence, se poursuit à l’âge adulte pour décroître dans la vieillesse. (1). Les allergies saisonnières comportent des symptômes typiques tels qu’éternuements, démangeaisons, congestion et écoulement nasal (ce qu’on appelle la rhinite allergique), toux, démangeaison et larmoiement des yeux, cernes, démangeaison de la gorge, fatigue, maux de tête et malaises.
- 10 juil 17
 La maladie de Parkinson touche entre 1 et 2% des personnes de plus de 65 ans et devient un problème croissant, car les baby boomers vieillissent. Cette pathologie se caractérise par des anomalies de démarche, une rigidité musculaire et un mouvement ralenti, on constate typiquement une difficulté à marcher ou à se lever d'une chaise. La maladie de Parkinson est un trouble du mouvement neurodégénératif et elle a des antécédents compliqués en termes de physiopathologie et de cause.
La maladie de Parkinson touche entre 1 et 2% des personnes de plus de 65 ans et devient un problème croissant, car les baby boomers vieillissent. Cette pathologie se caractérise par des anomalies de démarche, une rigidité musculaire et un mouvement ralenti, on constate typiquement une difficulté à marcher ou à se lever d'une chaise. La maladie de Parkinson est un trouble du mouvement neurodégénératif et elle a des antécédents compliqués en termes de physiopathologie et de cause. - 24 juil 14La dermatite atopique, appelée aussi eczéma, est une maladie inflammatoire cutanée chronique et/ou récurrente, qui se déclare souvent pendant l’enfance et persiste à l’âge adulte (1-3). D’après l’Association mondiale de l’allergie, le terme « atopique » désigne une prédisposition génétique à développer une réaction allergique et à produire des anticorps IgE en réponse à l’exposition à des allergènes, généralement des protéines (1-2,4). L’eczéma est associé à un certain nombre de troubles atopiques tels que les allergies alimentaires, les allergies saisonnières et l’asthme, ce qui suggère une pathogenèse commune et un risque plus élevé chez les personnes ayant des antécédents familiaux pour ces affections (1,3). Les éruptions eczémateuses ne sont pourtant pas toutes atopiques, témoin les éruptions provoquées par le sumac vénéneux ou par contact avec des substances chimiques irritantes (les deux étant des dermatites de contact). Dans cet article, nous utiliserons indifféremment les termes de dermatite atopique et d’eczéma.
- 08 Janv 15
 Si vous avez porté un intérêt vif pour vos soins de santé, vous avez surement entendu parler des bienfaits de la méditation et de la pleine conscience. Connaissez-vous par contre la vraie raison pour laquelle la méditation est si bénéfique? Les bienfaits les plus communs que l’on observe incluent une réduction du niveau d’anxiété, de la dépression et de la douleur. Ces données sont soutenues par plusieurs essais cliniques.
Si vous avez porté un intérêt vif pour vos soins de santé, vous avez surement entendu parler des bienfaits de la méditation et de la pleine conscience. Connaissez-vous par contre la vraie raison pour laquelle la méditation est si bénéfique? Les bienfaits les plus communs que l’on observe incluent une réduction du niveau d’anxiété, de la dépression et de la douleur. Ces données sont soutenues par plusieurs essais cliniques. - 27 juin 14La grossesse peut être un des moments les plus palpitants de la vie d'une femme. Elle peut aussi être un des moments les plus stressants, surtout si la grossesse est compliquée par des problèmes de santé. La grossesse a beaucoup d'"effets secondaires" courants et familiers, comme la nausée, les brûlures d'estomac et la fatigue. Mais il y a aussi des problèmes plus graves susceptibles d'apparaître après la grossesse, et les symptômes ne devraient pas être négligés ou ignorés, car ce sont des signes potentiels d'une maladie qui pourrait affecter la santé à long terme.
Actualités
Votre abonnement n'a pas pu être enregistré. Veuillez réessayer.
Vous vous êtes abonné avec succès à l’infolettre de Naturopathic Currents.
Les plus populaires
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13