Related Articles
- 31 7月 18在我的日常工作中,许多患者患有影响其生活质量的慢性病,而对此几乎没有「标准」解决方案。慢性恶化、体重增加、皮疹、头痛和关节疼痛等症状较为常见。
- 30 九月 18让我们来谈谈静脉注射(IV)营养治疗,这是一种常常被低估的治疗选择,用于治疗许多慢性病。静脉营养治疗在适当使用时是安全的,具有成本效益,对于一些最顽固的病例,有时会出乎意料地有效。
- 31 一月 19「关节炎」一词的意思是「关节发炎」,它源自希腊文ἄρθρον (árthron, 「关节」) 及 ‑ῖτις (‑îtis, 「与…有关」)。[1] 。多数人误以为关节炎只是一种个别的疾病,似乎只是指关节疼痛或关节疾病。
- 31 十月 18类风湿性关节炎(RA)是颇为常见的慢性疾病, 这种慢性的关节炎症可以对生活质素造成严重影响。
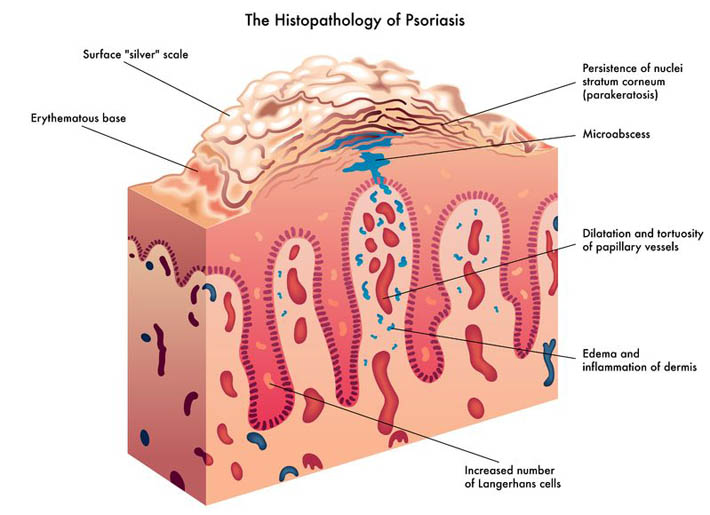
- 30 十一月 18炎症在医学界成为热门话题,而有关炎症的研究正持续增长。我们以往认为关节炎和关节炎症只限关节部位发炎,与身体其他部位无关。
- 28 二月 19对维持整体健康而言,健康的肠道是重要的一环。时至今天,似乎许多疾病和健康问题都源自肠道不平衡。
- 28 二月 19慢性疼痛是严重的健康问题,据估计慢性疼痛的患者有一半已受疼痛之苦超过10年1。在北美,估计有525万人确诊患有各种关节障碍2,而患者通常要服用非类固醇消炎药(NSAID)。这些药物有抑制称为细胞因子的促炎分子,就如白细胞介素(IL)-6、肿瘤坏死因子-α(TNFα)和前列腺素3。
- 31 一月 19不少会诊天然疗法医生的人关注消化方面的问题。然而在接受普通科医生的身体和血液检查后几个月,病人的情况仍然持续,以致病人要寻找新的医疗方向。
- 30 四月 18人体是脆弱的,容易严重受损,当我们年它时也会出现慢性退化。在医学上,我们应付受伤时肯定可以做的事情,例如消毒伤口、包裹伤口、骨折时用夹板作支架、用竹竿于受伤的骨盖施压等。
- 30 四月 18在一百年前,食物过敏这概念可谓无稽之谈。就算在大约十年前,「无麸质」或「乳制品过敏」等词汇依然鲜为人知,大部分人都不明白这些词汇所指的意思,也不理解它们有多重要。
- 06 九月 16
- 31 十二月 17医学上使用菇类已有几千年的历史,主要由于菇类对免疫系统、神经系统、肝脏及肾脏的益处。
- 31 五月 15免疫系统能自我分辨激发免疫系统的外来抗源或物质,保护受体免受感染及癌症。自体免疫性疾病的特征是免疫反应被解除(1)。
- 30 7月 14在最近几十年来,全球进食小麦的数量大幅上升(1)。小麦曾经被认为是健康饮食的一部分,但是现在对很多人来说却能危害健康。麸质的食物来源包括小麦、裸麦、大麦和谷物。更具体地说,它是一种合成蛋白,由麦醇溶蛋白和麦谷蛋白形成,主要在加工食物中用作稳定剂。乳糜泻(Celiac disease,CD)是一种复习的慢性免疫介导障碍,当进食麸质后会引发肠胃道症状。另一种疾病是非乳糜泻的麸质不耐(non-celiac gluten sensitivity,NCGS)。NCGS患者在进食麸质后也会出现症状,但与典型乳糜泻不同,以下我们将会讨论。这两种状况与小麦敏感完全不同。小麦敏感的患者是对麸质产生过敏反应,体内的免疫球蛋白E会增加。这篇文章会集中探讨CD及NCGS。在意大利一个有37间医疗中心参与的大型研究发现,患有NCGS的参与者占了3.2%(2)。患者的平均年龄是38岁,而女性患上此病的机会比男性多出5倍。至于证实患有CD的参与者占了2.8%。其他测试的疾病包括大肠激躁症、过敏及自体免疫性疾病。患者在接受实验室测试后,显示铁蛋白(铁含量)、叶酸及维生素D水平都偏低,意味着CD和NCGS可以使患者缺乏某些营养。
- 30 6月 14怀孕可能是女性一生中最激动的时刻之一。但同时也可能是最紧张的时刻,因为怀孕可能会导致各种并发症。常见的妊娠不良反应包括恶心、胃痛及疲劳等,但也可能会诱发其他更为严重的病症。这些病症不容忽视,因为它们可能是其他新病症的发病迹象,且可能极大影响长期健康状况。值得注意的是,怀孕期间女性的免疫系统会发生许多至关重要的变化,确保女性维持妊娠,而不是出现胎儿流产。这一过程被称为耐受性,指女性的免疫系统对引发免疫反应的物质出现无应答状态。正常情况下,免疫系统可以具有识别“自己”与“非己”的能力。正是因为这种识别能力,身体能够抵抗外来细菌及病毒感染。在妊娠状态下,孕妇的身体无法将胎儿识别出“非己”,并产生免疫应答。胎儿耐受性困扰了生物学家很多年,而且由于胎儿一半的DNA来自父亲,这与母亲本身的DNA不同,所以为何大多数女性不排斥胎儿仍然是未解之谜。
- 05 十二月 16
- 30 一月 15如果您想主动管理好自己身体的健康,那么您很可能曾听过有关冥想和正念的好处。但是,您是否明白为什么定期冥想是那么好?冥想普遍的好处包括减少忧虑、抑郁和痛楚的程度;有许多临床试验的数据可以证实(1)。然而,当这领域的科学研究增加,再结合科技的进步,已使我们对冥想眼界大开。借着冥想来练习正念,可以改善我们的脑部功能、免疫系统、慢性疾病,甚至减慢衰老的过程。
- 17 五月 16
- 06 五月 16
- 31 一月 14姜黄粉(turmeric)是一种调味品,金色,常用于东南亚和中东烹饪。除调味之外,它作为一种草药,也在多个医学学科中占重要地位。姜黄粉的药用作用可追溯至4000年前的印度,它有印度番红花(Indian saffron)、哈尔迪(haldi)、莪术(rhizoma curcumae)等别名,也因姜黄根茎(Curcuma longa)呈黄色被称为黄根。姜黄与姜同属姜科,主要成分为姜黄素(curcumin)和精油(volatile oil)(Ayurvedic medicine)。[1]本文将详细阐述姜黄粉在阿育吠陀医学和中医药中的作用及其安全性。
每月通讯
サブスクリプションを保存できませんでした。もう一度やり直してください。
サブスクリプションは成功しました。
最受欢迎
- 30 6月 13
- 26 6月 13
- 25 6月 13
- 28 6月 13
- 30 7月 13
- 30 6月 13
- 26 6月 13
- 25 6月 13
- 28 6月 13
- 30 7月 13
- 30 6月 13
- 26 6月 13
- 25 6月 13
- 28 6月 13
- 30 7月 13