Related Articles
- 31 Mayo 18El magnesio es el cuarto mineral más abundante en el cuerpo humano,[1] y es esencial para los cientos de reacciones metabólicas y hormonales que se producen a diario.[2]
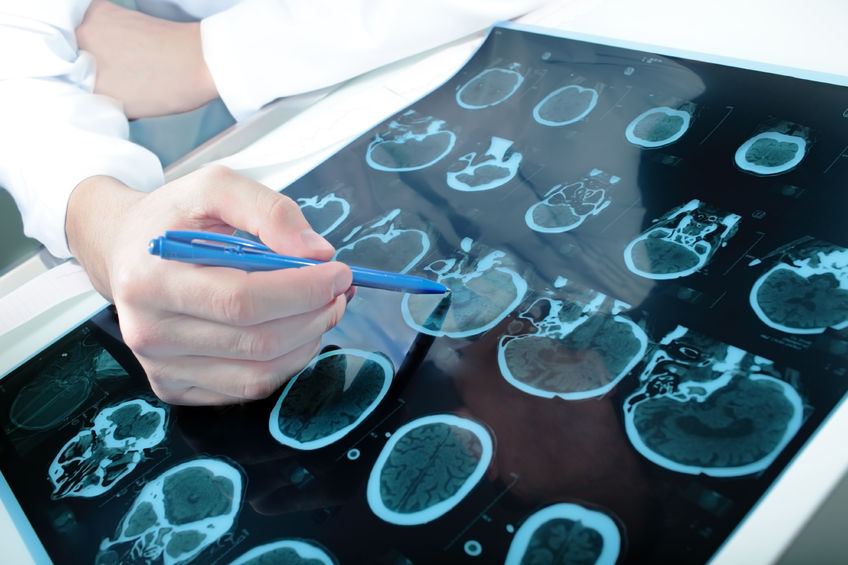
- 30 Nov 16La demencia es un término genérico para un conjunto de síntomas que son causados por trastornos que afectan al cerebro.
- 31 Ago 17Millones de personas sufren de algún tipo de dolor a diario. Sin importar si la causa es una lesión, una enfermedad o un defecto genético, el dolor crónico afecta la calidad de vida. Cuando el dolor limita la forma en que haces algo, o si haces algo, también hay un efecto psicológico.
- 30 Jun 16El uso de medicamentos complementarios para el tratamiento del cáncer y sus efectos secundarios se ha disparado en los últimos años.
- 31 Dic 16En Estados Unidos, el 73% de los niños y el 87% de los adultos consumen cafeína de manera regular [13].
- 14 Ago 19Los olvidos frecuentes a menudo se consideran una parte normal del envejecimiento. A medida que envejecemos, es normal que notemos cambios en nuestra memoria, capacidad de concentración, capacidad para hacer varias cosas a la vez y resolver problemas. La demencia se da cuando estos cambios en la cognición comienzan a afectar el funcionamiento diario. Con el envejecimiento de la población, se espera que la demencia se convierta en la principal causa de discapacidad en todo el mundo para 2020 (4). Los tratamientos actuales para la demencia son limitados y no tienen buenas tasas de éxito. Encontrar formas de prevenir, o al menos retrasar, el proceso de deterioro cognitivo relacionado con la edad es extremadamente importante.
- 09 Jul 15
 La crioterapia de cuerpo entero (CCE) es un tratamiento de promoción de la salud que implica exposiciones cortas a temperaturas del aire por debajo de -100 ° C. Tratamientos de CCE duran aproximadamente 2-5 minutos y la frecuencia de los tratamientos pueden variar en función de la finalidad de uso. El paciente se coloca en una pequeña cabina que emite una niebla seca fría que se filtra con succión a partir de un tanque adjunto de nitrógeno líquido.
La crioterapia de cuerpo entero (CCE) es un tratamiento de promoción de la salud que implica exposiciones cortas a temperaturas del aire por debajo de -100 ° C. Tratamientos de CCE duran aproximadamente 2-5 minutos y la frecuencia de los tratamientos pueden variar en función de la finalidad de uso. El paciente se coloca en una pequeña cabina que emite una niebla seca fría que se filtra con succión a partir de un tanque adjunto de nitrógeno líquido. - 31 Dic 15Nuestros ojos y nuestra visión son extremadamente importantes para nuestra calidad de vida. A medida que envejecemos, nuestros ojos tienden a deteriorarse, no solo con respecto a la agudeza, sino también en su salud general.
- 08 Jun 15
- 31 Ago 16¿Alguna vez se imaginó unas vacaciones maravillosas antes de que sucedieran? ¿Alguna vez ha dado un primer beso y lo ha repetido una y otra vez en su cabeza?
- 05 Ago 14
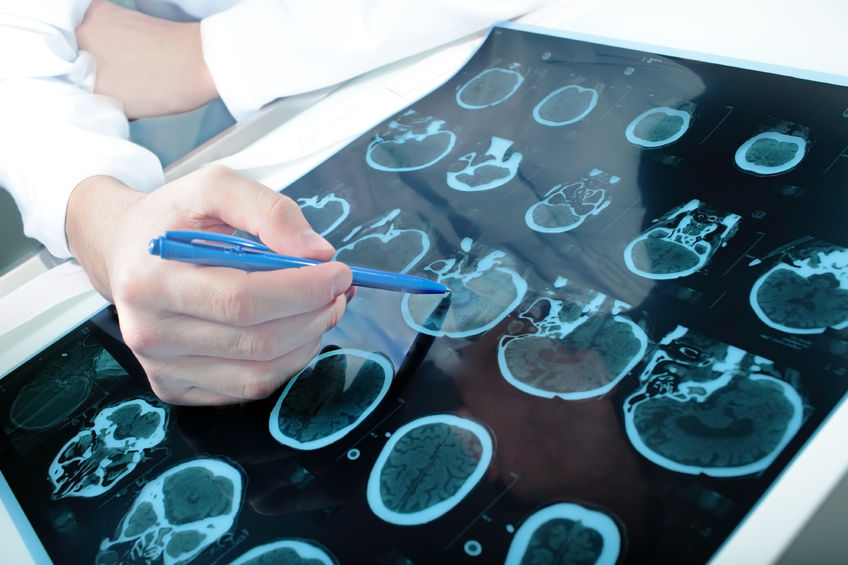 La enfermedad de Parkinson es una de las enfermedades neurodegenerativas crónicas y progresivas más comunes. Por lo general comienza después de los 50 años, y que afecta a aproximadamente el 1% de los individuos mayores de 60 años El riesgo de desarrollar esta afección es del 2% para los hombres y 1,3% para las mujeres.
La enfermedad de Parkinson es una de las enfermedades neurodegenerativas crónicas y progresivas más comunes. Por lo general comienza después de los 50 años, y que afecta a aproximadamente el 1% de los individuos mayores de 60 años El riesgo de desarrollar esta afección es del 2% para los hombres y 1,3% para las mujeres. - 03 Ene 14'; $link = url($path, array('absolute' => TRUE)); $nid = arg(1); if ($nid == 201401){ ?> download pdf
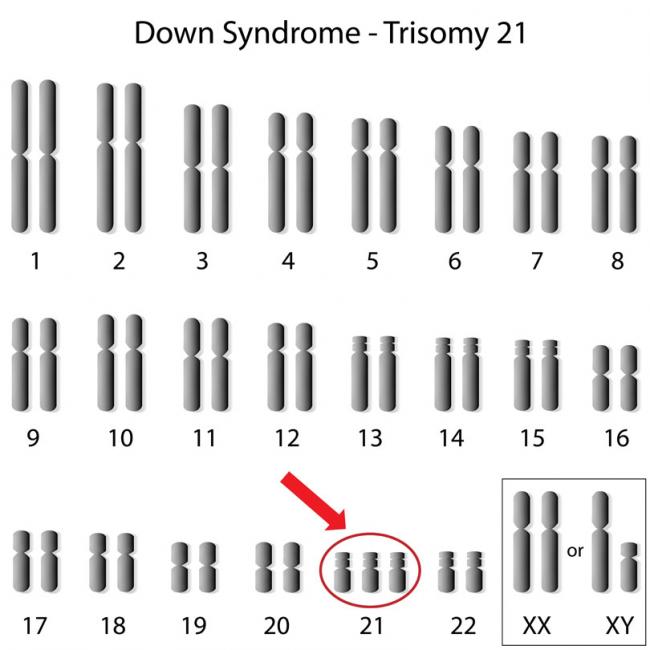
 El síndrome de fibromialgia (SFM) es una condición caracterizada por dolor crónico generalizado y fatiga extrema. Durante mucho tiempo se ha considerado como un diagnóstico controvertido, en gran parte debido a que su fisiopatología es poco conocida. Algunos han pensado que es una forma de hacerse el enfermo, o una afección psicosomática; mientras que otros la han visto como una enfermedad reumatológica o neurológica .31 Mayo 16El síndrome de Down recibió su nombre en 1866 cuando John Langdon Down describió este trastorno por primera vez.05 Mayo 14
El síndrome de fibromialgia (SFM) es una condición caracterizada por dolor crónico generalizado y fatiga extrema. Durante mucho tiempo se ha considerado como un diagnóstico controvertido, en gran parte debido a que su fisiopatología es poco conocida. Algunos han pensado que es una forma de hacerse el enfermo, o una afección psicosomática; mientras que otros la han visto como una enfermedad reumatológica o neurológica .31 Mayo 16El síndrome de Down recibió su nombre en 1866 cuando John Langdon Down describió este trastorno por primera vez.05 Mayo 14 La enfermedad de Alzheimer es una enfermedad cerebral progresiva que lleva a la pérdida de los recuerdos y causa problemas con el pensamiento. A medida que la degeneración progresa, puede conducir a la incapacidad para realizar las tareas más simples. Generalmente, los síntomas comienzan a aparecer después de los 60 años. La enfermedad de Alzheimer se considera la causa más común de demencia, lo que significa la pérdida de la función cognitiva y de algunas funciones relacionadas al comportamiento .31 Mar 17El término meditación puede significar diferentes cosas para distintas personas. Una persona puede imaginar a un monje sentado con las piernas cruzadas en silencio en un monasterio. Otra simplemente puede considerar cerrar los ojos en su escritorio y respirar profundo. Mientras que otra puede recordar al jugador de ajedrez en el parque con la atención tan concentrada que nada puede distraerlo.10 Feb 14'; $link = url($path, array('absolute' => TRUE)); $nid = arg(1); if ($nid == 201402){ ?> download pdf
La enfermedad de Alzheimer es una enfermedad cerebral progresiva que lleva a la pérdida de los recuerdos y causa problemas con el pensamiento. A medida que la degeneración progresa, puede conducir a la incapacidad para realizar las tareas más simples. Generalmente, los síntomas comienzan a aparecer después de los 60 años. La enfermedad de Alzheimer se considera la causa más común de demencia, lo que significa la pérdida de la función cognitiva y de algunas funciones relacionadas al comportamiento .31 Mar 17El término meditación puede significar diferentes cosas para distintas personas. Una persona puede imaginar a un monje sentado con las piernas cruzadas en silencio en un monasterio. Otra simplemente puede considerar cerrar los ojos en su escritorio y respirar profundo. Mientras que otra puede recordar al jugador de ajedrez en el parque con la atención tan concentrada que nada puede distraerlo.10 Feb 14'; $link = url($path, array('absolute' => TRUE)); $nid = arg(1); if ($nid == 201402){ ?> download pdf Con la creciente prevalencia de deterioro cognitivo, hay una necesidad de intervenciones del estilo de vida sostenibles para apoyar, mantener y mejorar la salud cognitiva. Como el ejercicio físico fortalece la salud del cuerpo, también hay una necesidad de entrenamiento mental. La evolución de la tecnología ofrece nuevos medios prometedores para el entrenamiento cognitivo. Este medio es el reino de la realidad virtual, los videojuegos y los dispositivos móviles que permiten el desarrollo de regímenes de entrenamiento individualizados adaptados a las necesidades de la persona. También puede haber la posibilidad de una inteligencia virtual que pueda ser capaz de preservar lo que el cerebro ya no puede contener.29 Feb 16El síndrome de las piernas inquietas (SPI) es una condición médica que afecta la parte del sistema nervioso que causa un impulso de mover las piernas.08 Jun 15
Con la creciente prevalencia de deterioro cognitivo, hay una necesidad de intervenciones del estilo de vida sostenibles para apoyar, mantener y mejorar la salud cognitiva. Como el ejercicio físico fortalece la salud del cuerpo, también hay una necesidad de entrenamiento mental. La evolución de la tecnología ofrece nuevos medios prometedores para el entrenamiento cognitivo. Este medio es el reino de la realidad virtual, los videojuegos y los dispositivos móviles que permiten el desarrollo de regímenes de entrenamiento individualizados adaptados a las necesidades de la persona. También puede haber la posibilidad de una inteligencia virtual que pueda ser capaz de preservar lo que el cerebro ya no puede contener.29 Feb 16El síndrome de las piernas inquietas (SPI) es una condición médica que afecta la parte del sistema nervioso que causa un impulso de mover las piernas.08 Jun 15 La niacina es una forma de vitamina B3. Niacinamida e inositol hexanicotinato son las otras dos formas de B3 que existen; estas formas generalmente son utilizadas para tratar diferentes condiciones dentro del cuerpo. Las vitaminas del grupo B en última instancia, ayudan al cuerpo a utilizar las grasas y las proteínas; también ayudan a convertir los alimentos en combustible que luego se utiliza para producir energía. 31 Ago 16El síndrome de fatiga crónica (SFC) es una enfermedad crónica que puede ser difícil de diagnosticar y tratar.06 Nov 14
La niacina es una forma de vitamina B3. Niacinamida e inositol hexanicotinato son las otras dos formas de B3 que existen; estas formas generalmente son utilizadas para tratar diferentes condiciones dentro del cuerpo. Las vitaminas del grupo B en última instancia, ayudan al cuerpo a utilizar las grasas y las proteínas; también ayudan a convertir los alimentos en combustible que luego se utiliza para producir energía. 31 Ago 16El síndrome de fatiga crónica (SFC) es una enfermedad crónica que puede ser difícil de diagnosticar y tratar.06 Nov 14 La S-Adenosilmetionina (SAMe) es una molécula ampliamente distribuida en todo el cuerpo y que es crucial en múltiples reacciones bioquímicas. La SAMe atrajo por primera vez la atención de los investigadores en 1970, y desde entonces se ha utilizado como un antidepresivo en Europa. Sin embargo no estuvo disponible en Norte América sino hasta los últimos 15 años aproximadamente. Bioquímicamente, la SAMe funciona como un donador de grupo metilo, y actúa en las mismas vías del ácido fólico y la vitamina B12.
La S-Adenosilmetionina (SAMe) es una molécula ampliamente distribuida en todo el cuerpo y que es crucial en múltiples reacciones bioquímicas. La SAMe atrajo por primera vez la atención de los investigadores en 1970, y desde entonces se ha utilizado como un antidepresivo en Europa. Sin embargo no estuvo disponible en Norte América sino hasta los últimos 15 años aproximadamente. Bioquímicamente, la SAMe funciona como un donador de grupo metilo, y actúa en las mismas vías del ácido fólico y la vitamina B12.
Boletín
No se pudo guardar su suscripción. Inténtalo de nuevo.
Su suscripción ha sido exitosa.
Más popular
- 16 Jun 13
- 17 Jun 13
- 17 Jun 13
- 16 Jun 13
- 01 Jul 13
- 16 Jun 13
- 17 Jun 13
- 17 Jun 13
- 16 Jun 13
- 01 Jul 13
- 16 Jun 13
- 17 Jun 13
- 17 Jun 13
- 16 Jun 13
- 01 Jul 13