Related Articles
- 06 Déc 18Vous sentez-vous parfois ballonné ou constipé ? Peut-être éprouvez-vous des maux de tête, ou des réactions cutanées, sans raison apparente ? Êtes-vous en permanence fatigué, incapable de vous concentrer ? L’origine de ces réactions pourrait bien vous surprendre, et est peut-être à chercher dans votre assiette.
- 01 Oct 13
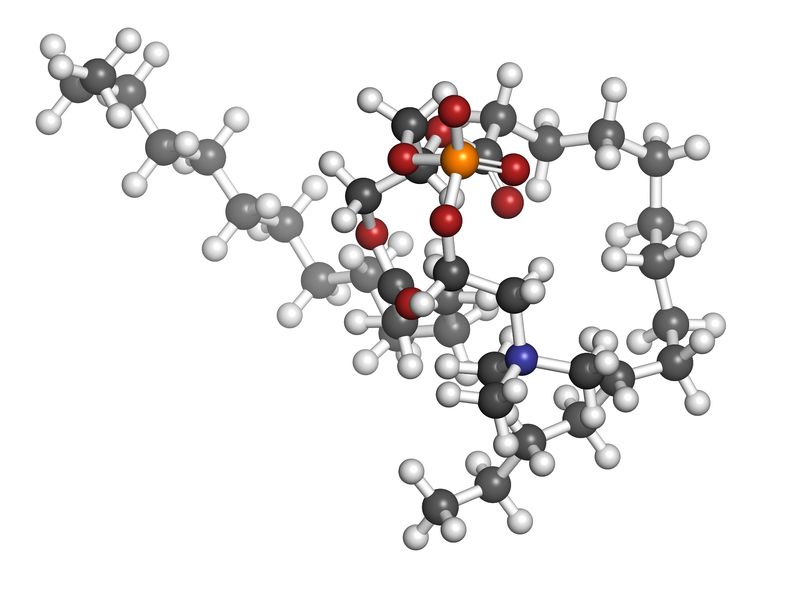
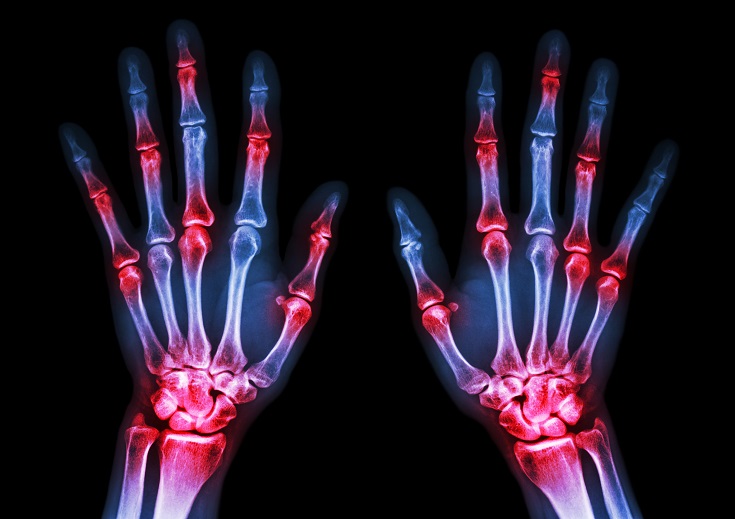
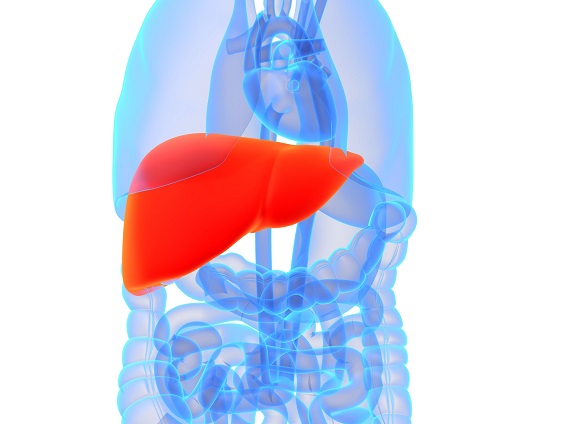
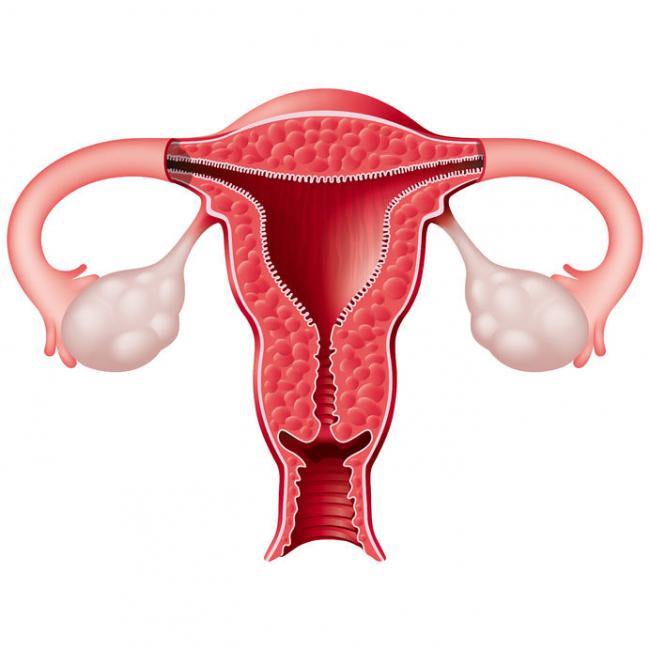
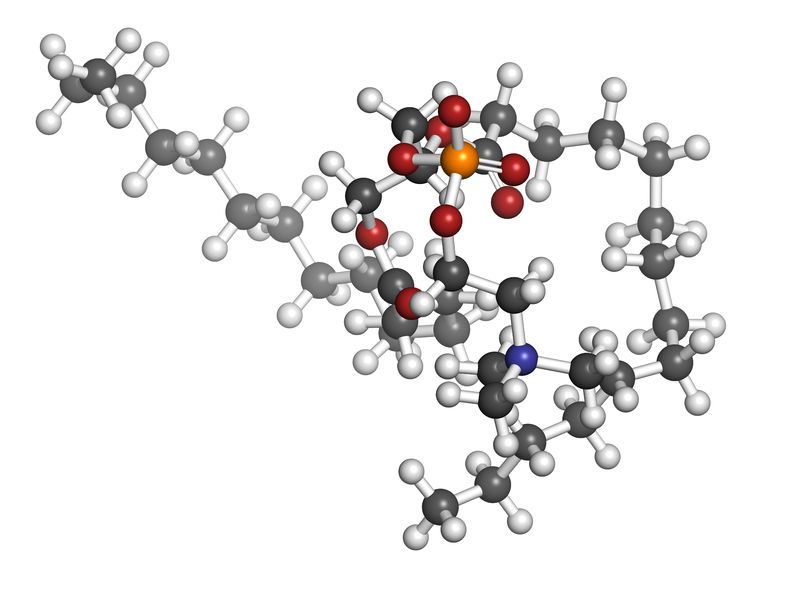 La phosphatidylcholine est un nutriment fascinant ayant un éventail impressionnant de fonctions peu connues pour la santé des humains. La phosphatidylcholine est un phospholipide essentiel servant de composant important à la membrane cellulaire composée de bicouches lipidiques. Elle est également une source de choline importante représentant 95% des réserves de choline dans les tissus.09 Mai 19L’acné est l’une des maladies cutanées chroniques les plus répandues : 80 à 90% de la population est touchée, un jour ou l’autre, par l’acné [1]. Il s’agit d’une affection relativement bénigne, qui peut pourtant avoir des effets très lourds sur la santé psychique. On observe, indépendamment de sa gravité, un taux plus élevé d’anxiété et de dépression chez les personnes qui en sont atteintes [2]. Alors même que les lésions acnéiques ont disparu, les cicatrices et traces pigmentaires qui peuvent subsister ont parfois un impact durable sur l’estime de soi et le bien-être psychologique. Ces seules raisons justifient que l’on recherche des solutions efficaces pour lutter contre l’acné.16 Mars 19Plus de 50% des femmes souffriront au cours de leur vie d’une infection urinaire (IU). Entre un tiers et la moitié de ces femmes auront une IU récurrente d’ici un an. Une IU est dite récurrente lorsqu’elle survient au moins trois fois sur une période de 12 mois [1]. Les antibiotiques constituent le traitement le plus couramment utilisé contre ces affections, mais leur usage répétitif entraine une résistance aux antibiotiques qui suscite une prise de conscience et une inquiétude grandissantes. Cette préoccupation explique l’intérêt pour les traitements alternatifs contre les IU. Nous allons parler de ces affections, de leurs causes, et des moyens alternatifs pour les prévenir et les soigner.23 juil 18Beaucoup de patients viennent me consulter pour des maladies qui affectent leur qualité de vie mais pour lesquelles il n’existe que peu ou pas de solution « standard ». Des symptômes tels qu’une fatigue qui s’aggrave progressivement, une prise de poids, des éruptions cutanées, des maux de tête et des douleurs articulaires sont fréquents. Ces symptômes restent souvent inexpliqués par la médecine conventionnelle pour ce qui est de leur origine, et ne sont pas pris en charge, ou ne le sont que de façon insuffisante, par les traitements pharmaceutiques. Bien que ces traitements soient essentiels dans de nombreuses circonstances, ils ne sont trop souvent, pour ces symptômes chroniques, pas la meilleure solution.16 Janv 19Une bonne partie des personnes qui consultent un médecin naturopathe le font principalement pour des problèmes digestifs. Après des mois d’examens et d’analyses, leur médecin conventionnel les a laissées sans réponse claire, et elles sont à la recherche d’un nouveau point de vue. D’autres fois, leurs examens d’imagerie révèlent quelque chose d’important, mais le système médical est malgré tout à court d’options thérapeutiques.30 Oct 18La polyarthrite rhumatoïde (PR) est une affection chronique relativement répandue. Il s’agit d’une forme d’inflammation articulaire chronique qui peut avoir un impact important sur la qualité de vie. On ne sait pas précisément ce qui provoque la polyarthrite rhumatoïde, mais l’affection présente une composante auto-immune significative. Elle diffère en cela nettement de l’arthrose, bien plus fréquente, qui est plutôt une arthrite d’usure provoquée par l’utilisation mécanique des articulations au cours d’une vie longue et active. La polyarthrite rhumatoïde n’affecte pas seulement les articulations, mais s’accompagne de symptômes inflammatoires systémiques.16 Févr 19La douleur chronique constitue un problème de santé important, et l’on estime que la moitié des personnes atteintes de douleur chronique en souffrent depuis plus de 10 ans [1]. Environ 52,5 millions de Nord-Américains ont reçu un diagnostic de troubles arthritiques [2], des affections généralement traitées avec des anti-inflammatoires non-stéroïdiens (AINS). Ces médicaments agissent en inhibant des molécules pro-inflammatoires appelées cytokines, notamment l’interleukine IL-6, le facteur de nécrose tumorale alpha (TNFα), et les prostaglandines [3]. Il est bien connu que l’utilisation prolongée d’AINS comme l’ibuprofène et le paracétamol entraine des effets secondaires tels qu’ulcères, hémorragie gastro-intestinale, brûlures d’estomac, ballonnements et gaz [4]. On sait également que les AINS contribuent à l’hyperperméabilité du tube digestif, appelée aussi « syndrome de l’intestin perméable » [5]. Ces facteurs peuvent entrainer le développement d’allergies, d’une colonisation bactérienne chronique de l’intestin grêle, du syndrome du côlon irritable (SCI), entre autres troubles digestifs.23 juil 18Chacun de nos organes joue un rôle unique et essentiel dans l’équilibre de notre corps. L’harmonie qui résulte de leur bon fonctionnement commun est une véritable source d’énergie – mais le contraire, lui, nous épuise. Le foie est un facteur important de notre santé et constitue un carrefour entre de nombreux systèmes organiques. Nous savons que le foie filtre et détoxifie le sang, qu’il produit certaines hormones et protéines essentielles, mais il remplit aussi d’autres fonctions plus discrètes que nous ne remarquons pas – jusqu’à ce que les choses commencent à aller de travers. Malgré toutes les formes de stress que nous imposons à notre organisme, notre foie est capable de résister aux traumas que constituent l’alcool, les drogues, certains aliments, et aux infections, et peut même se régénérer au besoin !16 Févr 19L’état de nos intestins est une part essentielle de notre santé globale. De nombreux problèmes de santé et maladies viennent aujourd’hui d’un déséquilibre intestinal. Notre alimentation, le stress que nous pouvons éprouver, ainsi que notre exposition aux agents toxiques sont à la source d’une dysbiose intestinale, qui affecte notre humeur, notre vitalité et notre énergie. Nous attaquons la journée avec moins d’entrain, et notre quotidien devient plus une corvée qu’autre chose.16 Avr 19On décrit généralement le syndrome des ovaires polykystiques (SOPK) comme un trouble hormonal, mais c’est aussi, et peut-être avant tout, un trouble métabolique. Les femmes atteintes du SOPK présentent souvent des symptômes de dérèglements hormonaux divers, y compris des troubles de la reproduction, qui se manifestent d’ordinaire par un allongement des règles et une ovulation irrégulière. En outre, on observe fréquemment une dérégulation à long terme du métabolisme des lipides et de l’équilibre de l’insuline et du glucose, pouvant, à terme, entrainer une stéatose hépatique non alcoolique (SHNA). Les autres symptômes courants du SOPK sont notamment l’acné (ce que j’appelle une « barbe d’acné », d’après la zone du visage et du cou où elle apparait), une croissance anormale de poils sur le visage, ainsi que des difficultés à perdre du poids, en particulier la graisse corporelle. Ces troubles apparaissent généralement lorsque le taux d’hormones androgènes, telles que la testostérone, devient trop élevé, les ovaires cessant alors de fonctionner normalement.22 Avr 18Il y a cent ans, l'idée d'être "sensible" à un aliment aurait paru absurde. Ne serait-ce qu'il y a dix ans, les termes "sans gluten" et "allergie aux produits laitiers" étaient rares et la plupart des gens jugeaient sans savoir ce qu'ils signifiaient ou pourquoi c'était important. Aujourd'hui, la plupart des écoles sont des établissements sans fruits à coque, et des lois sont passées pour garantir une description claire de tous les ingrédients d'un produit sur l'emballage.22 Avr 18Quand on part en voyage dans des régions tropicales ou subtropicales, il y a toujours une chance de contracter une infection bactérienne qui se transforme en diarrhée du voyageur. On estime qu'environ 30 à 50% des voyageurs contractent une diarrhée du voyageur durant le deux premières semaines à l'étranger.[1][2][3]21 Mai 18L'"infection à levures chronique" est une affection assez courante, mais souvent peu reconnue, que j'ai pu observer dans le cadre de ma profession de docteur en naturopathie; vous en avez peut-être entendu parler. Elle est aussi appelée syndrome de prolifération de Candida (ou COS, de l'anglais Candida Overgrowth Syndrome). Cette affection peut se manifester par divers symptômes bénins, systémiques et non spécifiques, qui peuvent rester inexpliqués et non traités pendant des mois, voire des années parfois, pour beaucoup de patient(e)s.16 Avr 1717 juil 16
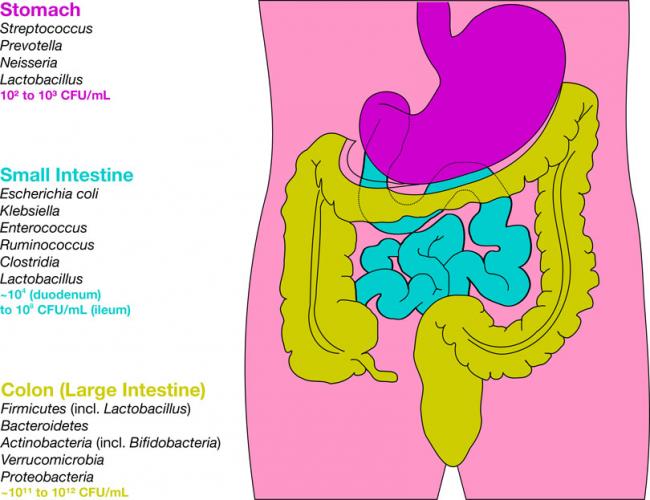
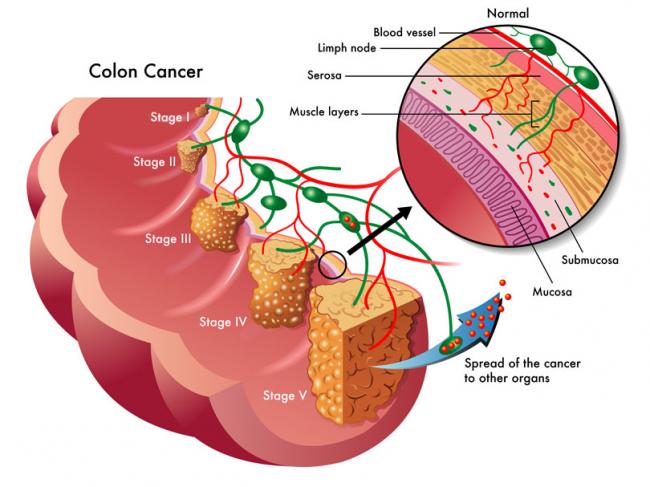
La phosphatidylcholine est un nutriment fascinant ayant un éventail impressionnant de fonctions peu connues pour la santé des humains. La phosphatidylcholine est un phospholipide essentiel servant de composant important à la membrane cellulaire composée de bicouches lipidiques. Elle est également une source de choline importante représentant 95% des réserves de choline dans les tissus.09 Mai 19L’acné est l’une des maladies cutanées chroniques les plus répandues : 80 à 90% de la population est touchée, un jour ou l’autre, par l’acné [1]. Il s’agit d’une affection relativement bénigne, qui peut pourtant avoir des effets très lourds sur la santé psychique. On observe, indépendamment de sa gravité, un taux plus élevé d’anxiété et de dépression chez les personnes qui en sont atteintes [2]. Alors même que les lésions acnéiques ont disparu, les cicatrices et traces pigmentaires qui peuvent subsister ont parfois un impact durable sur l’estime de soi et le bien-être psychologique. Ces seules raisons justifient que l’on recherche des solutions efficaces pour lutter contre l’acné.16 Mars 19Plus de 50% des femmes souffriront au cours de leur vie d’une infection urinaire (IU). Entre un tiers et la moitié de ces femmes auront une IU récurrente d’ici un an. Une IU est dite récurrente lorsqu’elle survient au moins trois fois sur une période de 12 mois [1]. Les antibiotiques constituent le traitement le plus couramment utilisé contre ces affections, mais leur usage répétitif entraine une résistance aux antibiotiques qui suscite une prise de conscience et une inquiétude grandissantes. Cette préoccupation explique l’intérêt pour les traitements alternatifs contre les IU. Nous allons parler de ces affections, de leurs causes, et des moyens alternatifs pour les prévenir et les soigner.23 juil 18Beaucoup de patients viennent me consulter pour des maladies qui affectent leur qualité de vie mais pour lesquelles il n’existe que peu ou pas de solution « standard ». Des symptômes tels qu’une fatigue qui s’aggrave progressivement, une prise de poids, des éruptions cutanées, des maux de tête et des douleurs articulaires sont fréquents. Ces symptômes restent souvent inexpliqués par la médecine conventionnelle pour ce qui est de leur origine, et ne sont pas pris en charge, ou ne le sont que de façon insuffisante, par les traitements pharmaceutiques. Bien que ces traitements soient essentiels dans de nombreuses circonstances, ils ne sont trop souvent, pour ces symptômes chroniques, pas la meilleure solution.16 Janv 19Une bonne partie des personnes qui consultent un médecin naturopathe le font principalement pour des problèmes digestifs. Après des mois d’examens et d’analyses, leur médecin conventionnel les a laissées sans réponse claire, et elles sont à la recherche d’un nouveau point de vue. D’autres fois, leurs examens d’imagerie révèlent quelque chose d’important, mais le système médical est malgré tout à court d’options thérapeutiques.30 Oct 18La polyarthrite rhumatoïde (PR) est une affection chronique relativement répandue. Il s’agit d’une forme d’inflammation articulaire chronique qui peut avoir un impact important sur la qualité de vie. On ne sait pas précisément ce qui provoque la polyarthrite rhumatoïde, mais l’affection présente une composante auto-immune significative. Elle diffère en cela nettement de l’arthrose, bien plus fréquente, qui est plutôt une arthrite d’usure provoquée par l’utilisation mécanique des articulations au cours d’une vie longue et active. La polyarthrite rhumatoïde n’affecte pas seulement les articulations, mais s’accompagne de symptômes inflammatoires systémiques.16 Févr 19La douleur chronique constitue un problème de santé important, et l’on estime que la moitié des personnes atteintes de douleur chronique en souffrent depuis plus de 10 ans [1]. Environ 52,5 millions de Nord-Américains ont reçu un diagnostic de troubles arthritiques [2], des affections généralement traitées avec des anti-inflammatoires non-stéroïdiens (AINS). Ces médicaments agissent en inhibant des molécules pro-inflammatoires appelées cytokines, notamment l’interleukine IL-6, le facteur de nécrose tumorale alpha (TNFα), et les prostaglandines [3]. Il est bien connu que l’utilisation prolongée d’AINS comme l’ibuprofène et le paracétamol entraine des effets secondaires tels qu’ulcères, hémorragie gastro-intestinale, brûlures d’estomac, ballonnements et gaz [4]. On sait également que les AINS contribuent à l’hyperperméabilité du tube digestif, appelée aussi « syndrome de l’intestin perméable » [5]. Ces facteurs peuvent entrainer le développement d’allergies, d’une colonisation bactérienne chronique de l’intestin grêle, du syndrome du côlon irritable (SCI), entre autres troubles digestifs.23 juil 18Chacun de nos organes joue un rôle unique et essentiel dans l’équilibre de notre corps. L’harmonie qui résulte de leur bon fonctionnement commun est une véritable source d’énergie – mais le contraire, lui, nous épuise. Le foie est un facteur important de notre santé et constitue un carrefour entre de nombreux systèmes organiques. Nous savons que le foie filtre et détoxifie le sang, qu’il produit certaines hormones et protéines essentielles, mais il remplit aussi d’autres fonctions plus discrètes que nous ne remarquons pas – jusqu’à ce que les choses commencent à aller de travers. Malgré toutes les formes de stress que nous imposons à notre organisme, notre foie est capable de résister aux traumas que constituent l’alcool, les drogues, certains aliments, et aux infections, et peut même se régénérer au besoin !16 Févr 19L’état de nos intestins est une part essentielle de notre santé globale. De nombreux problèmes de santé et maladies viennent aujourd’hui d’un déséquilibre intestinal. Notre alimentation, le stress que nous pouvons éprouver, ainsi que notre exposition aux agents toxiques sont à la source d’une dysbiose intestinale, qui affecte notre humeur, notre vitalité et notre énergie. Nous attaquons la journée avec moins d’entrain, et notre quotidien devient plus une corvée qu’autre chose.16 Avr 19On décrit généralement le syndrome des ovaires polykystiques (SOPK) comme un trouble hormonal, mais c’est aussi, et peut-être avant tout, un trouble métabolique. Les femmes atteintes du SOPK présentent souvent des symptômes de dérèglements hormonaux divers, y compris des troubles de la reproduction, qui se manifestent d’ordinaire par un allongement des règles et une ovulation irrégulière. En outre, on observe fréquemment une dérégulation à long terme du métabolisme des lipides et de l’équilibre de l’insuline et du glucose, pouvant, à terme, entrainer une stéatose hépatique non alcoolique (SHNA). Les autres symptômes courants du SOPK sont notamment l’acné (ce que j’appelle une « barbe d’acné », d’après la zone du visage et du cou où elle apparait), une croissance anormale de poils sur le visage, ainsi que des difficultés à perdre du poids, en particulier la graisse corporelle. Ces troubles apparaissent généralement lorsque le taux d’hormones androgènes, telles que la testostérone, devient trop élevé, les ovaires cessant alors de fonctionner normalement.22 Avr 18Il y a cent ans, l'idée d'être "sensible" à un aliment aurait paru absurde. Ne serait-ce qu'il y a dix ans, les termes "sans gluten" et "allergie aux produits laitiers" étaient rares et la plupart des gens jugeaient sans savoir ce qu'ils signifiaient ou pourquoi c'était important. Aujourd'hui, la plupart des écoles sont des établissements sans fruits à coque, et des lois sont passées pour garantir une description claire de tous les ingrédients d'un produit sur l'emballage.22 Avr 18Quand on part en voyage dans des régions tropicales ou subtropicales, il y a toujours une chance de contracter une infection bactérienne qui se transforme en diarrhée du voyageur. On estime qu'environ 30 à 50% des voyageurs contractent une diarrhée du voyageur durant le deux premières semaines à l'étranger.[1][2][3]21 Mai 18L'"infection à levures chronique" est une affection assez courante, mais souvent peu reconnue, que j'ai pu observer dans le cadre de ma profession de docteur en naturopathie; vous en avez peut-être entendu parler. Elle est aussi appelée syndrome de prolifération de Candida (ou COS, de l'anglais Candida Overgrowth Syndrome). Cette affection peut se manifester par divers symptômes bénins, systémiques et non spécifiques, qui peuvent rester inexpliqués et non traités pendant des mois, voire des années parfois, pour beaucoup de patient(e)s.16 Avr 1717 juil 16 L’acné vulgaire représente la pathologie dermatologique la plus fréquente vue par les médecins. Cette maladie peut causer beaucoup de détresse, entraînant chez certains une baisse de l’estime de soi. Les scores de santé mentale chez les patients atteints d’acné sont plus élevés comparés à un certain nombre d’autres pathologies chroniques. Souvent, les malades utilisent des médicaments allopathiques tels que la pilule contraceptive, des stéroïdes diurétiques (Spironolactone) ou encore le rétinoïde : Accutane, spécifique à l’acné. 23 Févr 16Le microbiome humain est défini comme l’ensemble des gènes de tous les microbes dans le corps humain. Il comprend de 10 à 100 billions de cellules microbiennes symbiotiques, soit dix fois plus que le nombre de cellules humaines. Le génome d’une personne est identique à 99,9 % à celui de n’importe quelle autre personne ; cependant, leur microbiome présente une similarité de 10 % à 20 % seulement. Cela montre toute l’importance du microbiome dans la différenciation d’une personne par rapport à une autre.06 juil 19Ma fleur est l’une des premières à s’ouvrir au printemps. Sur les pelouses soigneusement entretenues, mon jaune vif et gai se remarque très vite. Je suis partout, et tout le monde me reconnait. Je m’implante sans rien demander à personne et suis bien difficile à éliminer. Vous l’avez sans doute deviné : je suis le pissenlit, l’obstiné pissenlit.18 Avr 16En 2015, 1 homme sur 14 et 1 femme sur 16 ont été diagnostiqués comme souffrant d’un cancer colorectal. Il s’agit de la deuxième cause de décès par cancer pour les hommes, avec 1 chance sur 29 d’en mourir, et de la troisième cause de décès par cancer pour les femmes.05 Oct 16
L’acné vulgaire représente la pathologie dermatologique la plus fréquente vue par les médecins. Cette maladie peut causer beaucoup de détresse, entraînant chez certains une baisse de l’estime de soi. Les scores de santé mentale chez les patients atteints d’acné sont plus élevés comparés à un certain nombre d’autres pathologies chroniques. Souvent, les malades utilisent des médicaments allopathiques tels que la pilule contraceptive, des stéroïdes diurétiques (Spironolactone) ou encore le rétinoïde : Accutane, spécifique à l’acné. 23 Févr 16Le microbiome humain est défini comme l’ensemble des gènes de tous les microbes dans le corps humain. Il comprend de 10 à 100 billions de cellules microbiennes symbiotiques, soit dix fois plus que le nombre de cellules humaines. Le génome d’une personne est identique à 99,9 % à celui de n’importe quelle autre personne ; cependant, leur microbiome présente une similarité de 10 % à 20 % seulement. Cela montre toute l’importance du microbiome dans la différenciation d’une personne par rapport à une autre.06 juil 19Ma fleur est l’une des premières à s’ouvrir au printemps. Sur les pelouses soigneusement entretenues, mon jaune vif et gai se remarque très vite. Je suis partout, et tout le monde me reconnait. Je m’implante sans rien demander à personne et suis bien difficile à éliminer. Vous l’avez sans doute deviné : je suis le pissenlit, l’obstiné pissenlit.18 Avr 16En 2015, 1 homme sur 14 et 1 femme sur 16 ont été diagnostiqués comme souffrant d’un cancer colorectal. Il s’agit de la deuxième cause de décès par cancer pour les hommes, avec 1 chance sur 29 d’en mourir, et de la troisième cause de décès par cancer pour les femmes.05 Oct 16
Actualités
Votre abonnement n'a pas pu être enregistré. Veuillez réessayer.
Vous vous êtes abonné avec succès à l’infolettre de Naturopathic Currents.
Les plus populaires
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13