Related Articles
- 13 5月 18マグネシウムは、体内で4番目に豊富なミネラルで、[1]日々生じる数多くの代謝やホルモン反応に不可欠です。[2]骨の形成に役立つことが広く知られていて(カルシウムとともに)、その天然の筋弛緩作用により睡眠補助薬として関心が高まっています。しかし、これはマグネシウムの数多くの利点のほんの一部にすぎなく、神経や筋肉の正常な機能、心拍の維持、免疫系の健康に必要です。[1][3]このように、マグネシウムは、喘息、片頭痛、自閉症スペクトラム障害、心血管疾患、糖尿病、さらには癌を含め、幅広い疾患において重要な役割を果たしているため、特定の慢性疾患を治療する場合は考慮すべきです。
- 31 8月 17何百万人もの人々が、何らかの種類の日常的な痛みに苦しんでいます。その原因が怪我、疾病、あるいは遺伝子異常であろうとなかろうと、慢性痛は生活の質に影響します。痛みが原因であなたの行動が制限されたり、行動することを諦めたりする時には、心理的な影響も生じます。
- 06 11月 14
 S-アデノシルメチオニン(SAMe: S-Adenosylmethionine)は、数多くの生化学反応に極めて重要な全身くまなく分布している分子です。最初にS-アデノシルメチオニンは1970年代に注目を集め、その時以来、欧州では抗うつ剤として使われてきました[1]。しかし、北米では15年前くらいまでS-アデノシルメチオニンは入手できませんでした。生化学的に、S-アデノシルメチオニンはメチル基供与体として働き、葉酸およびビタミンB12と同じ経路で作用します。これらの経路のうち最も有名なのはホモシステイン回路で、これはホモシステインをメチオニンへと再循環させ、その過程で葉酸、ビタミンB12およびS-アデノシルメチオニンを使い尽くします。
S-アデノシルメチオニン(SAMe: S-Adenosylmethionine)は、数多くの生化学反応に極めて重要な全身くまなく分布している分子です。最初にS-アデノシルメチオニンは1970年代に注目を集め、その時以来、欧州では抗うつ剤として使われてきました[1]。しかし、北米では15年前くらいまでS-アデノシルメチオニンは入手できませんでした。生化学的に、S-アデノシルメチオニンはメチル基供与体として働き、葉酸およびビタミンB12と同じ経路で作用します。これらの経路のうち最も有名なのはホモシステイン回路で、これはホモシステインをメチオニンへと再循環させ、その過程で葉酸、ビタミンB12およびS-アデノシルメチオニンを使い尽くします。 - 08 1月 15
- 09 7月 15
- 05 5月 1401 12月 1617 6月 1616 5月 1608 6月 1530 4月 17パーキンソン病(PD)は、最も一般的な神経変性疾患の一つで、年齢65歳を超える人々の1-2%が罹患しています。パーキンソン病は、安静時の震え、歩行、椅子に座る・立ち上がるのが困難、振り向きが困難、筋肉の強張り、表情の変化、筆跡の縮小、その他多数の運動症状を呈します。非運動症状も一般的で、それらには、便秘、嗅覚消失、起立性低血圧症、疲労、抑うつ、不安、そして-特に-睡眠異常が含まれます。05 8月 1403 1月 14'; $link = url($path, array('absolute' => TRUE)); $nid = arg(1); if ($nid == 201401){ ?> download pdf13 1月 1709 7月 1512 8月 19
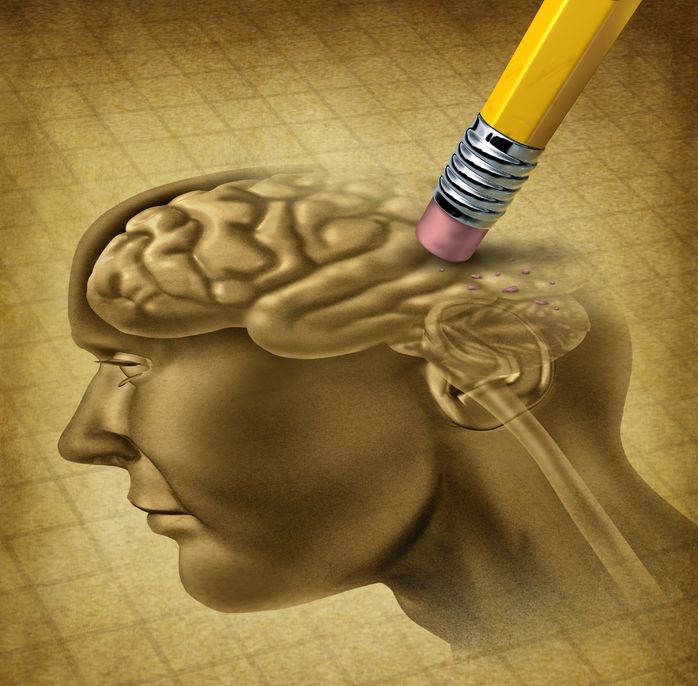
 もちろん、認知症を予防するには、その他、様々なライフスタイルを変更することも大切で、定期的な運動や認知訓練、脳活動の維持、社会参加もすべて重要な手段です。食生活とともにライフスタイルを変更した場合、食事内容のみを変更した場合よりも、認知症のリスクが大幅に減少するといわれています(8)。また、こうした変更を行うのに早すぎたり遅すぎたりすることはありません。早期予防計画の一環として、またはすでに記憶力の低下を経験している場合でさえ、食事内容やライフスタイルを変更することで、脳の健康と機能に大きな効果をもたらす可能性があります!17 8月 1622 12月 1531 3月 17瞑想という言葉は、人によって異なるものを意味するかも知れません。お寺であぐらをかいて静かに座るお坊さんのイメージのある人もいるかも知れません。30 6月 17
もちろん、認知症を予防するには、その他、様々なライフスタイルを変更することも大切で、定期的な運動や認知訓練、脳活動の維持、社会参加もすべて重要な手段です。食生活とともにライフスタイルを変更した場合、食事内容のみを変更した場合よりも、認知症のリスクが大幅に減少するといわれています(8)。また、こうした変更を行うのに早すぎたり遅すぎたりすることはありません。早期予防計画の一環として、またはすでに記憶力の低下を経験している場合でさえ、食事内容やライフスタイルを変更することで、脳の健康と機能に大きな効果をもたらす可能性があります!17 8月 1622 12月 1531 3月 17瞑想という言葉は、人によって異なるものを意味するかも知れません。お寺であぐらをかいて静かに座るお坊さんのイメージのある人もいるかも知れません。30 6月 17
月刊ニュースレター
サブスクリプションを保存できませんでした。もう一度やり直してください。
サブスクリプションは成功しました。