Related Articles
- 16 Mars 19Alors que l’hiver 2019 bat son plein, la grippe et sa cohorte de symptômes sont au rendez-vous. Le froid nous contraint à rester à l’intérieur, nous exposant à échanger nos bactéries, nos virus et autres agents pathogènes mutuels. Vous rappelez-vous cet inconnu que vous avez croisé dans le métro ? Oui, celui avec une toux sèche, le nez qui coule, les yeux rouges et larmoyants, de la fièvre, des frissons, des courbatures, et autres manifestations déplaisantes...
- 23 Août 15Les infections des voies urinaires inférieures que nous appellerons IU dans cet article sont responsables de milliers de rendez-vous médicaux annuellement, car les voies urinaires se situent au deuxième rang en termes de fréquence d’infection. Le terme infection urinaire fait allusion à la présence du nombre de bactéries dans l’urine, soit en général plus de 100 000/ml.
- 16 Mars 19Plus de 50% des femmes souffriront au cours de leur vie d’une infection urinaire (IU). Entre un tiers et la moitié de ces femmes auront une IU récurrente d’ici un an. Une IU est dite récurrente lorsqu’elle survient au moins trois fois sur une période de 12 mois [1]. Les antibiotiques constituent le traitement le plus couramment utilisé contre ces affections, mais leur usage répétitif entraine une résistance aux antibiotiques qui suscite une prise de conscience et une inquiétude grandissantes. Cette préoccupation explique l’intérêt pour les traitements alternatifs contre les IU. Nous allons parler de ces affections, de leurs causes, et des moyens alternatifs pour les prévenir et les soigner.
- 24 Sept 18Le frottis cervico-vaginal, ou test Pap, a pour la santé des femmes une importance particulière, puisqu’il permet de réduire l’incidence du cancer du col de l’utérus [1]. Mais avec tant de phases différentes présentées par les cellules atypiques ou anormales, avant même leur évolution tumorale, il peut être difficile pour les femmes de comprendre ce que signifient les résultats de leur test Pap, et de savoir comment réagir dans l’intérêt de leur santé.
- 24 Sept 18L’appareil urinaire est la partie du système excréteur qui élimine les déchets et les métabolites superflus de l’organisme pour en maintenir l’homéostasie et l’équilibre biochimique. Constitué par les reins, les uretères, la vessie et l’urètre, l’appareil urinaire est supposé stérile, en dehors de l’urètre.
- 23 juil 18Chacun de nos organes joue un rôle unique et essentiel dans l’équilibre de notre corps. L’harmonie qui résulte de leur bon fonctionnement commun est une véritable source d’énergie – mais le contraire, lui, nous épuise. Le foie est un facteur important de notre santé et constitue un carrefour entre de nombreux systèmes organiques. Nous savons que le foie filtre et détoxifie le sang, qu’il produit certaines hormones et protéines essentielles, mais il remplit aussi d’autres fonctions plus discrètes que nous ne remarquons pas – jusqu’à ce que les choses commencent à aller de travers. Malgré toutes les formes de stress que nous imposons à notre organisme, notre foie est capable de résister aux traumas que constituent l’alcool, les drogues, certains aliments, et aux infections, et peut même se régénérer au besoin !
- 22 Avr 18Quand on part en voyage dans des régions tropicales ou subtropicales, il y a toujours une chance de contracter une infection bactérienne qui se transforme en diarrhée du voyageur. On estime qu'environ 30 à 50% des voyageurs contractent une diarrhée du voyageur durant le deux premières semaines à l'étranger.[1][2][3]
- 21 Mai 18L'"infection à levures chronique" est une affection assez courante, mais souvent peu reconnue, que j'ai pu observer dans le cadre de ma profession de docteur en naturopathie; vous en avez peut-être entendu parler. Elle est aussi appelée syndrome de prolifération de Candida (ou COS, de l'anglais Candida Overgrowth Syndrome). Cette affection peut se manifester par divers symptômes bénins, systémiques et non spécifiques, qui peuvent rester inexpliqués et non traités pendant des mois, voire des années parfois, pour beaucoup de patient(e)s.
- 05 Oct 16
 L’endométriose se caractérise par la présence de tissu endométrial en dehors de l’utérus. Ces lésions tissulaires réagissent à des stimuli hormonaux, comme les œstrogènes, et peuvent causer de très fortes douleurs pelviennes chez bien des femmes. La maladie présente de nombreux stades et degrés différents.
L’endométriose se caractérise par la présence de tissu endométrial en dehors de l’utérus. Ces lésions tissulaires réagissent à des stimuli hormonaux, comme les œstrogènes, et peuvent causer de très fortes douleurs pelviennes chez bien des femmes. La maladie présente de nombreux stades et degrés différents. - 10 Janv 17
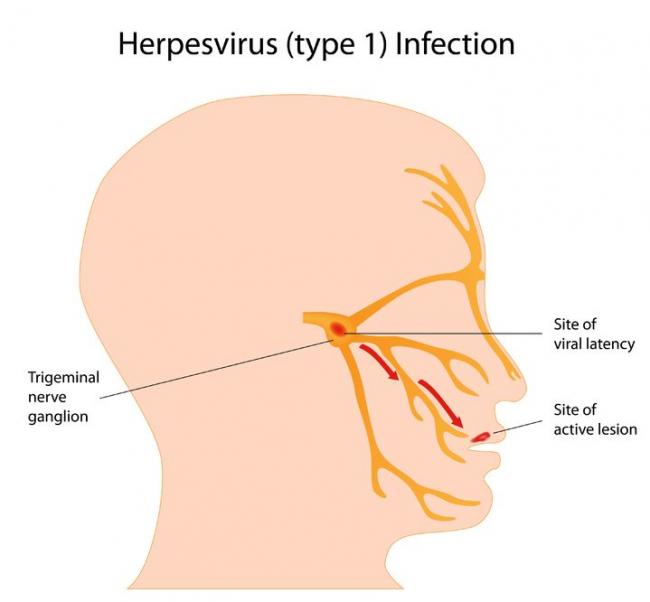
- 18 juin 18Le zona est souvent présenté comme une infection concernant les personnes âgées. Nous voyons à la télévision des publicités pour le vaccin contre le zona dont les acteurs ont tous plus de 60 ans. Il est possible que la douleur liée au zona soit plus invalidante avec l’âge, mais en réalité toute personne qui a déjà eu la varicelle peut avoir un zona, quel que soit son âge.
- 08 Oct 17
 Les autres symptômes sont notamment l’augmentation de la fréquence urinaire, et une sensation d’urgence et de pression dans la région pelvienne. L’objet de cet article est de passer en revue les facteurs-clés contribuant à la CI ainsi que les thérapies basées sur l’expérience permettant de traiter chacun de ces facteurs.
Les autres symptômes sont notamment l’augmentation de la fréquence urinaire, et une sensation d’urgence et de pression dans la région pelvienne. L’objet de cet article est de passer en revue les facteurs-clés contribuant à la CI ainsi que les thérapies basées sur l’expérience permettant de traiter chacun de ces facteurs. - 08 Janv 15
 Le terme dysplasie cervicale se réfère aux cellules anormales présentes sur la surface du col de l’utérus considérées précancéreuses et pouvant mener au cancer. 1) La dysplasie cervicale est principalement causée par une infection transmise sexuellement aux différentes souches du virus du papillome humain (VPH). Des souches différentes peuvent être impliquées autant dans les lésions bénignes que malignes, ce qui signifie que la progression de la maladie semble être dépendante de facteurs individuels. Les études suggèrent qu’une exposition au VPH est l’événement initiateur pouvant entrainer le développement de la dysplasie cervicale, aussi nommée néoplasie intraépithéliale cervicale (CIN).
Le terme dysplasie cervicale se réfère aux cellules anormales présentes sur la surface du col de l’utérus considérées précancéreuses et pouvant mener au cancer. 1) La dysplasie cervicale est principalement causée par une infection transmise sexuellement aux différentes souches du virus du papillome humain (VPH). Des souches différentes peuvent être impliquées autant dans les lésions bénignes que malignes, ce qui signifie que la progression de la maladie semble être dépendante de facteurs individuels. Les études suggèrent qu’une exposition au VPH est l’événement initiateur pouvant entrainer le développement de la dysplasie cervicale, aussi nommée néoplasie intraépithéliale cervicale (CIN). - 23 Avr 15La grippe intestinale est l’appellation populaire de ce que les médecins nomment gastro-entérite, qui désigne pour l’essentiel une inflammation du tube digestif, comprenant l’estomac et les intestins. Cette affection provoque un ensemble de symptômes très déplaisants, combinant le plus souvent diarrhée, vomissements, douleurs et crampes abdominales (1). D’autres symptômes peuvent aussi se manifester : nausées, perte d’appétit, et signes de déshydratation pour les cas les plus sévères. La gastro-entérite de type viral est la plus fréquente, provoquée par un petit nombre de virus différents. Le norovirus est courant chez les enfants d’âge scolaire, dans les hôpitaux et à bord des bateaux de croisière. Le rotavirus est la cause majeure de gastro-entérite grave chez les enfants (il existe des vaccins contre ce virus). D’autres virus sont moins fréquents, comme l’astrovirus et l’adénovirus entérique. Les personnes immunodéprimées (ou dont le système immunitaire est affaibli pour une raison quelconque), y compris les très jeunes et les très âgées, sont les plus exposées aux formes sévères de gastro-entérite (2).
- 24 Oct 14Les infections respiratoires, particulièrement la bronchite aiguë et la pneumonie, sont parmi les maladies les plus courantes et les plus tenaces. Elles sont non seulement perturbantes et douloureuses tant que dure l’infection, mais leurs effets peuvent encore se faire sentir des semaines après. On a observé que la toux caractéristique de ces infections pouvait durer jusqu’à quatre semaines après l’infection initiale (1). Fièvre et fatigue sont des symptômes communs à toutes les infections. La bronchite aiguë est provoquée par une inflammation des bronchioles, les tubes apportant l’air qui gonfle les poumons. Quand elles sont infectées, les voies respiratoires bronchiques rétrécissent et s’encombrent de mucus, rendant difficile l’entrée de l’air dans les poumons. L'inflammation provoque également des spasmes de ces voies respiratoires, entrainant une toux persistante, sèche ou grasse. Les symptômes caractéristiques de la bronchite sont notamment une toux grasse et spasmodique, productive ou non, ainsi qu’une respiration courte et sifflante (1). La bronchite aiguë est souvent causée par un virus, rarement par une bactérie (2).
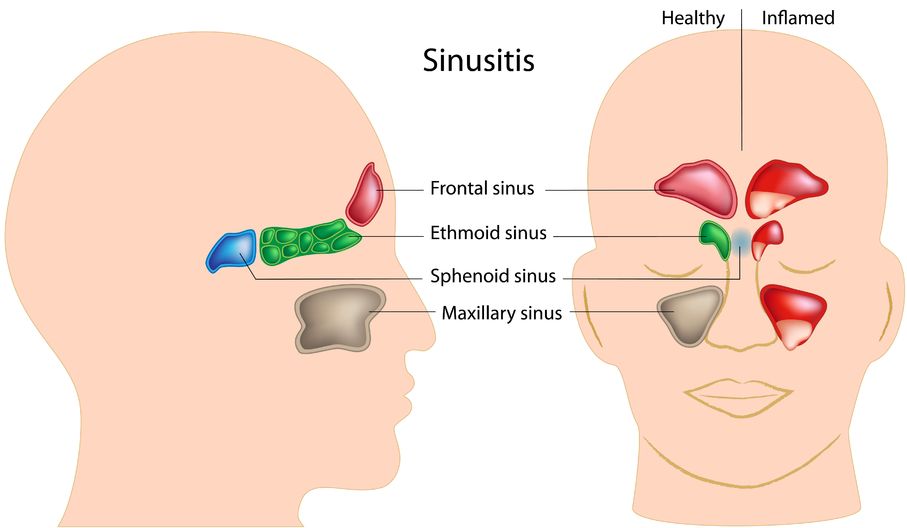
- 24 Oct 14La sinusite se définit comme l’inflammation des sinus. Ceux-ci sont un ensemble d’orifices ou de cavités dans les os du crâne. Les plus grands sont les sinus maxillaires, situés près des pommettes, dont on se plaint généralement quand on ressent une douleur faciale. Les autres sinus comprennent les sinus frontaux, ethmoïdaux, et sphénoïdaux (1). Les inflammations et les gonflements touchent souvent plusieurs sinus ensemble, et l’inflammation des plus petits peut provoquer une congestion et des problèmes respiratoires. Les sinus étant tapissés de tissus mous et d’une fine couche de mucus, l’inflammation entraine rapidement une sensation d’obstruction. Il existe plusieurs types d’affections des sinus, provoquant des symptômes irritants et parfois débilitants.
- 23 Mars 16L’infection vaginale à levures, ou vaginite candidosique, est une affection qui peut se révéler très inconfortable, et avoir un impact important sur la qualité de vie des femmes. Au moins 75% des femmes souffriront au moins une fois dans leur vie d’une vaginite, 45% deux fois ou plus, et de 5 à 8% connaitront des infections fréquentes et récurrentes au cours de leur vie. La vaginite candidosique n’est pas classée parmi les maladies sexuellement transmissibles (MST), mais peut être transmise lors d’un rapport sexuel, ou au bébé au cours de la naissance.
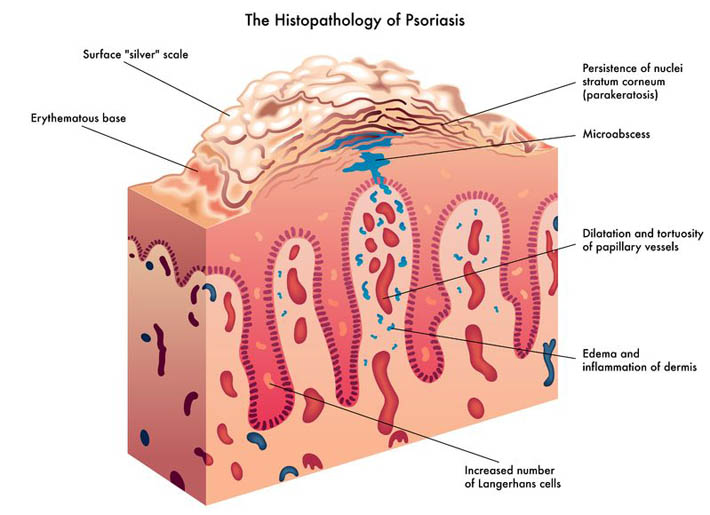
- 23 Sept 15Le psoriasis est une maladie de peau chronique dont les symptômes peuvent varier d’intensité. Il se caractérise par une croissance très rapide des cellules cutanées, provoquant d’épaisses plaques blanchâtres ou rouges (1). En temps normal, les cellules de l’épiderme ont un cycle de vie d’une durée d’un mois, une nouvelle peau se développant pour remplacer l’ancienne.
- 23 juil 15L’herpès est une infection virale de la peau et des muqueuses provoquée par le virus Herpes simplex (HSV). Les lésions peuvent se produire dans différentes zones, en particulier sur ou autour de la bouche, des lèvres, des organes génitaux et des yeux. Il existe deux types de HSV : le HSV-1 et le HSV-2. Le premier est responsable du caractéristique herpès labial ; il a donc une prédisposition pour la bouche et les lèvres, mais peut aussi provoquer un herpès génital dans un petit nombre de cas. Le HSV-2, pour sa part, est le principal virus de l’herpès qui affecte les zones génitales (1).
- 23 Mars 15L’Origanum vulgare (nom latin de l’origan) a fait l’objet de nombreuses études en raison de ses usages cliniques potentiels tout à la fois intéressants et stimulants, et peut-être aussi du fait de la tendance actuelle, dans plusieurs secteurs industriels, à remplacer les substances chimiques de synthèse par des produits naturels aux propriétés similaires. Beaucoup de composants bioactifs sont présents dans les plantes aromatiques et peuvent en être extraits de plusieurs façons. Les principaux composants de l’huile essentielle d’origan mis en évidence par une étude sont le carvacrol, l’alcool bêta-fenchyl, le thymol et le gamma-terpinène (1).
Actualités
Votre abonnement n'a pas pu être enregistré. Veuillez réessayer.
Vous vous êtes abonné avec succès à l’infolettre de Naturopathic Currents.
Les plus populaires
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13
- 16 juin 13
- 17 juin 13
- 17 juin 13
- 17 juin 13
- 01 juil 13