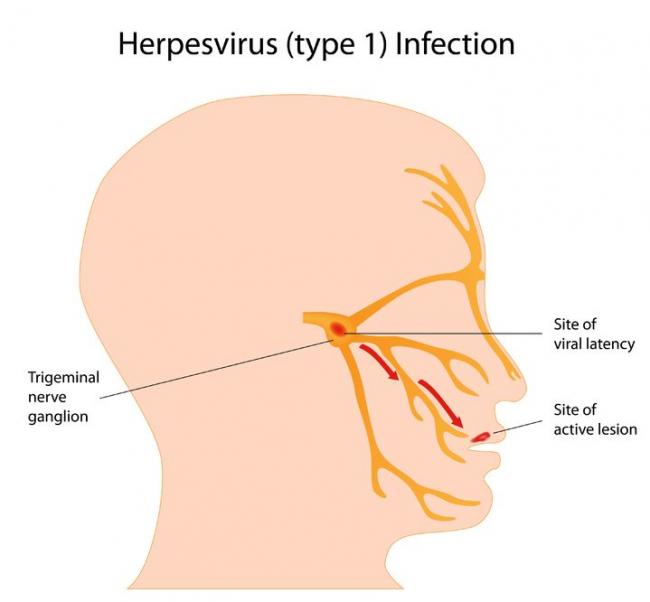
异质性皮炎 - 瘙痒问题
by: Crystal Ceh HBSc., ND
Toronto, Ontario
www.Crystalcehnd.com
什么是异质性皮炎?
异质性皮炎亦称湿疹,是一种慢性反复性皮肤炎症,通常在儿童时期发病并持续至成年[1-3]。根据世界过敏症协会报道,“异质性”即在蛋白质等过敏原刺激下,易于发生过敏反应并产生IgE抗体的基因体质[1-2,4]。湿疹是一种常见发病机理,与食物过敏、季节性过敏和哮喘等多种异质性疾病相关,具有上述疾病家族病史的人群更易感染湿疹 [1,3]。然而湿疹不全为异质性,如接触有毒藤蔓或化学物质/刺激性物质[二者均为接触性皮炎]。本文将交替使用异质性皮炎和湿疹两个名词。
尽管湿疹发病部位可遍及全身,但婴儿发病部位通常在脸颊和四肢外部,儿童和成人在颈部、手肘、膝关节等弯曲表面 [3]。湿疹的症状包括皮肤干燥、发红、出现鳞片、肿胀、渗透、严重瘙痒,以及机能障碍导致的持续抓挠使皮肤变厚。湿疹会导致难以治愈的抓挠,造成出血、失眠、注意力下降、抑郁和自信问题 [1-3]。湿疹的其他严重症状包括抓挠造成的细菌二次感染,以及皮炎[大面积湿疹严重渗透]等少见症状,出现以上症状均需要及时就诊。诊断依据有临床评估、病史和通过SCORAD[异质性皮炎评分]或SASSAD[异质性皮炎6部位6症状]指数评估的疾病严重性 [3]。干燥天气、热水澡、羊毛等粗糙材料会加剧湿疹,研究表明压力过大、睡眠不足也会降低皮肤的防御功能,刺激湿疹发病 [1,5]
湿疹是一种全球多发病,20%的儿童和3%成年人都患过该疾病,发达国家发病率上升更为显著 [4]。治疗湿疹的经济成本堪比癫痫、肺气肿等慢性疾病 [1]现有的几种传统疗法只强调治疗湿疹的症状,因此湿疹的预防措施和有效疗法对缓解病情十分重要。接下来我们将探讨这种常见病的潜在病因。
 湿疹的病因是什么
T到底要不要消毒?卫生假说
湿疹的病因是什么
T到底要不要消毒?卫生假说
在工业社会中,尽管无菌环境可抑制该疾病的传播和感染,但病理学数据显示,湿疹等异质性疾病的发病率仍在上升。研究者斯特拉肯在90年代初期提出了“卫生假说”的概念,他观察到家庭人数减少导致传染性药物使用减少,从而提高了过敏性疾病的发病率 [6-7]。尽管发展中国家缺乏健全的健康标准,寄生虫状况严重,但过敏性疾病发病率仍然很低 [8]。移民研究表明,从低发病率地区移民至高发病率地区的人群,下一代中过敏性疾病的发病率会上升 [8]。
这项假设表明适应性免疫细胞Th 1和Th 2反应中存在不平衡。童年早期缺乏细菌/病毒影响,Th1为主的免疫反应较弱,免疫系统以Th2反应为主,Th1细胞受到限制,易造成异质性疾病 [6-8]。关键在于童年的感染疾病会使免疫系统倾向于一种反应。然而,这种假说不能完全解释运行中的免疫机制或克罗恩病和多发性硬化症等Th1主导的自身免疫疾病。
肠虫:微生物假说
人体中肠道细菌的数量是肠道细胞的10倍,这也是婴儿体内微生物分布最广的部位 [9]。在正常状况下,这些友好的共生细菌可促进肠道功能,如分解未消化的食物纤维、释放重要维生素、控制肠道细胞生长分化等 [9,10]。肠道微生物最重要的功能之一就是刺激人体最大的免疫器官——肠相关淋巴组织 [gut-associated lymphoid tissue, GALT]并促进食物等良性物质的耐受性。这种刺激作用贯穿终生,但在胎儿期和出生后最为重要 [10]。胎儿出生后,这类友好细菌立即定殖,并受分娩方式、孕期微生物、基因、母乳喂养和其他环境因素影响 [10,11]。几项病理学研究显示了肠道微生物和湿疹等过敏性疾病之间的联系,但与卫生假说相同的是,微生物假说也难以完全解释湿疹和其他异质性疾病的发病机理。
中间丝相关蛋白基因的作用
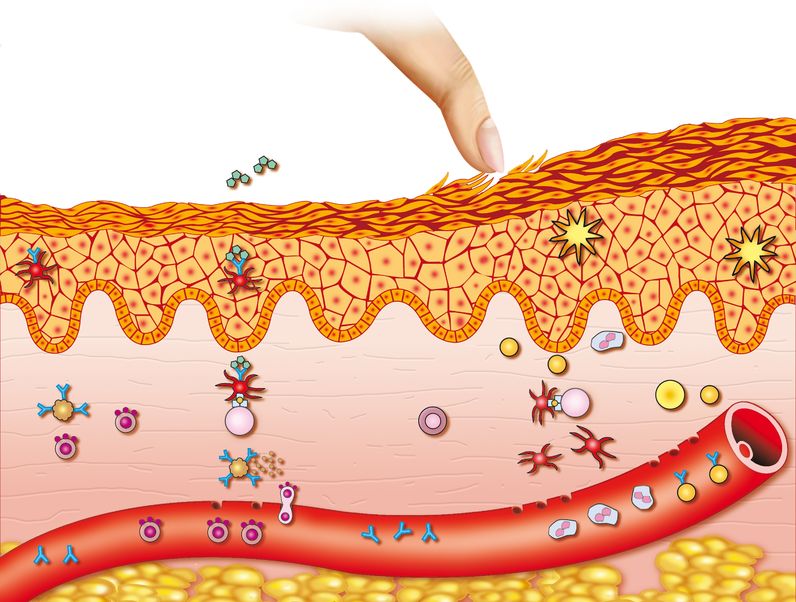
皮肤是人体最大的器官,其功能在于形成身体与外界的屏障、减少水分流失和预防病原体和过敏原侵入系统 [12]。影响皮肤屏障功能形成的一项关键基因就是中间丝相关蛋白 [filaggrin, FLG],它为皮肤防止水分流失和微生物侵入的蛋白质进行编码。多项人体研究表明,该基因变异与皮肤屏障功能受损相关,会导致皮肤干燥、瘙痒,易引发湿疹 [13]。研究者认为这种损伤会导致敏化,最终引发湿疹 [12,13]。我们将探讨压力对湿疹的恶化作用。
 压力与皮肤:精神神经免疫学
压力与皮肤:精神神经免疫学
尽管人们普遍认为压力与湿疹等多种慢性病相关,精神神经免疫学[PNI]为压力源造成人体生理变化的途径提供了证据。精神神经免疫学是研究中枢神经系统、内分泌系统和免疫系统复杂的交互反应的领域 [14]。心理压力的定义是真实或想象的环境需求超出能力的事件,可分为急性和慢性压力源 [14]。急性压力可适用于数种病例,如在“战斗还是逃跑”的反应中,下丘脑-垂体-肾上腺轴和交感神经系统提高心跳和呼吸速率,促进血液流通至骨骼肌,提高血糖水平以应对压力 [15]。另一方面,慢性压力有多种有害作用,如提高疾病易感性和严重程度、减慢伤口愈合速度、显著提高前炎因子水平等 [14]。
皮肤包含多种感觉纤维网络,与中枢神经系统传递多种相同的神经递质和受体,如羟色胺、促肾上腺皮质激素和P物质 [16]。皮肤也有棉衣、神经和内分泌系统联系紧密,并通过化学信使双向传递信息 [16]。化学信使异常与湿疹的病理生理学有关。
一项研究中,研究者让未患湿疹的患者接受心理社会压力测试,参与者需要进行演讲并在观众面前完成算术任务。结果表明,湿疹患者测试后的嗜酸粒水平显著提高,这与慢性过敏性炎症和湿疹密切相关 [17]。此外,结果表明湿疹患者接受压力源的24小时内,KgE抗体水平显著提高。IgE是促进湿疹发病的一种重要粒子,它刺激嗜碱细胞和肥大细胞,导致超敏反应 [17]。另外,IgE使其他细胞激活Th2调节的免疫反应。
另一项研究中,研究者调查了压力对皮肤屏障功能的影响。受试者在寒假之后的低压力阶段、二月期末考的高压力阶段和压力阶段后的4周分别接受评估 [18]。通过蒸发器、心理状态档案 [Profile of Mood States, POMS]和知觉压力量表 [Perceived stress scale, PSS] ,研究者发现,压力最大的受试者皮肤的屏障功能受损越严重,经表皮失水率[trans-epidermal water loss, TEWL]越高,经表皮和皮肤损伤越严重 [18]。作者总结道,这项研究表明了压力和湿疹等炎性皮肤病发病或恶化之间的相关性。
 湿疹的自然疗法
益生菌
湿疹的自然疗法
益生菌
多项询证研究表明,益生菌对防治湿疹等多种疾病都有显著疗效。据世界健康组织报道,益生菌堪称“活着的微生物系统,适量益生菌可促进宿主健康” [19]。
几项随机控制实验表明,产前和产后服用益生菌补充剂可显著降低湿疹的2年内累积发病率 [20-25]。此外,母乳中的免疫因子也对预防过敏性疾病有重要作用,研究表明,仅使用母乳喂养6个月以上可以显著降低高危婴儿的湿疹发病风险 [19,26]。最后,一项荟萃分析表明,与服用安慰剂相比,孕妇服用乳酸菌补充剂可显著降低儿童2-7岁时的湿疹发病率 [27]。乳酸菌、鼠李糖乳杆菌GG、L. 乳酸杆菌、L. 清酒乳杆菌、唾液乳杆菌、乳双歧杆菌和交叉双歧杆菌等菌群都有预防效果。
相似的是,益生菌对治疗湿疹也有作用。2012年的一项研究表明,与安慰剂相比,1-3岁有湿疹病史的儿童服用8周交叉双歧杆菌、乳酸杆菌、干酪乳酸杆菌、唾液乳杆菌补充剂后,SCORAD评分、血清特异性IgE和免疫因子均有所下降 [19]。德拉格等人另一项相似的研究表明,与安慰剂相比,成人服用唾液乳杆菌LS01 16周可显著降低SCORAD和Th1/Th2因子的比例 [19]。然而,根据系统性观点和荟萃分析,益生菌治疗湿疹的效果仍不全面。其中一个原因即为各项研究的异质性,包括研究对象和益生菌群的选用。
超敏食谱
许多临床医生认为,营养性过敏原可引发湿疹,其中牛奶、鸡蛋、小麦和黄豆的作用最明显 [28]。超敏食谱移除了此类食物,时长为3周到数月,再逐渐引入此类食物,以观察过敏反应是否加剧。多项出版研究表明,不含蛋类和牛奶的食谱可显著减轻婴儿的湿疹患病率,而仅依照不含蛋类的食谱,湿疹仍会发病。
根据德国EAACI文章,实行超敏食谱3周以上可减轻严重的湿疹 [29]。此外,一项针对100名婴儿和儿童的初步研究表明,不食用某些致敏食物可显著降低湿疹的SCORAD指数 [30]。最后,一项更新的研究表明,成人依照超敏食谱3周以上可减轻除苔藓样硬化外的全部主观变量和SCORAD变量 [31]。遗憾的是,由于人体RCT不够严格,以及剔除某些食物可能导致儿童生长期营养不良,超敏食谱也因此受到批评。在任何情况下,都有足够理论和观察证据表明,试用超敏食谱3周以上可观测病人湿疹状况中食物过敏的作用,此时临床医生应密切监督病人的食谱,并补充缺乏的营养素。
皮肤的特定营养素
有几种特定营养素可促进皮肤的屏障作用,减轻炎症,治疗湿疹症状。局部疗法对治疗皮肤干燥、炎症和瘙痒等湿疹症状尤为重要。超敏润滑剂可减轻经表皮失水[TEWL],保持上皮神经酰胺,并减轻瘙痒。近期一项双盲安慰剂控制实验发现,持续2到4周局部补充维生素B12可显著减轻湿疹损伤 [33]。
研究表明,Omega-3脂肪酸EPA和DHA与上皮神经酰胺合并,因此可降低皮肤渗透率、减轻干燥和瘙痒,减少皮肤炎症 [34]。研究表明,儿童16周使用500mg包含40mg GLA和10mg维生素E的月见草油可显著减轻湿疹症状 [35]。最后,1600 IU维生素D3和600IU维生素E[α-生育酚]60天后可显著降低湿疹病人的SCORAD分数 [36]。
鉴于湿疹的复杂性,自然疗法医生应当使用多种疗法,重视疾病的症状和病因。
References
1) Foisy M, Boyle RJ, Chalmers JR, Simpson EL, Williams HC. The prevention of eczema in infants and children: an overview of Cochrane and non-Cochrane reviews. Evid Based Child Health. 2011;6(5):1322–39.
2) Thomas KS, Dean T, O’Leary C, Sach TH, Koller K, Frost A, Pallett I, Crook AM, Meredith S, Nunn AJ, Burrows N, Pollock I, Graham-Brown R, O'Toole E, Potter D, Williams HC. A randomised control trial of ion-exchange water softeners for the treatment of eczema in children. PLoS Med. 2011;8(2):1-11.
3) Bath-Hextall F & Williams H. Eczema (atopic). Clin Evid (Online). 2006;2006:1716.
4) Fiocchi A, Burks W, Bahna SL, Bielory L, Boyle RJ, Cocco R, Dreborg S, Goodman R, Kuitunen M, Haahtela T, Heine RG, Lack G, Osborn DA, Sampson H,Tannock GW, Lee BW; WAO Special Committee on Food Allergy and Nutrition. Clinical use of probiotics in pediatric allergy (CUPPA): a World Allergy Organization position paper. WAO J. 2012; 5(11): 148–167.
5) Altemus A, Rao B, Dhabhar FS, Ding W, Granstein RD. Stress-induced changes in skin barrier function in healthy women. J of Invest Derm. 2001; 117:309-17.
6) Strachan DP. Family size, infection and atopy: the first decade of the “hygiene hypothesis”. Thorax. 2000; 55(Suppl 1):S2-S10.
7) Schaub B, Lauener R, von Mutuis E. The many faces of the hygiene hypothesis. J Allergy Clin Immunol. 2006; 117(5):969-77.
8) Okada H, Kuhn C, Feillet H, Bach J-F. The “hygiene hypothesis” for autoimmune and allergic diseases: an update. Clin Exp Immunol. 2010; 160(1): 1–9.
9) Toh ZQ, Anzela A, Tang MLK, Licciardi PV. Probiotic therapy as a novel approach for allergic disease. Front in Pharm. 2012; 3(171):1-14.
10) Savilahti E, Kukkonen K, Kuitunen M. Probiotics in the treatment and prevention of allergy in children. WAO Journal. 2009; 2:69-76.
11) Kim H-J, Kim HY, Lee S-Y, Seo J-H, Lee E, Hong S-J. Clinical efficacy and mechanism of probiotics in allergic diseases. Korean J Pediatr. 2013; 56(9):369-76.
12) Ziyab AH, Karmaus W, Yousefi M, Ewart S, Schauberger E, Holloway JW, Zhang H, Arshad SH. Interplay of filaggrin loss-of-function variants, allergic sensitization, and eczema in a longitudinal study covering infancy to 18 years of age. PLoS One. 2012; 7(3):1-9.
13) Sandilands A, Sutherland C, Irvine AD, McLean WHI. Filaggrin in the frontline: role in skin barrier function and disease. J of Cell Sci. 2009; 122(9):1285-94.
14) Glaser R, Kiecold-Glaser JK. Stress-induced immune dysfunction: implications for health. J Immunol. 2005; 5:243-51.
15) Godbout JP, Glaser R. Stress-induced immune dysregulation: implications for wound healing, infectious disease and cancer. J Neuroimmune Pharm. 2006; 1:421-27.
16) Suarez AL, Feramisco JD, Koo J, Steinhoff M. Psychoneuroimmunology of psychological stress and atopic dermatitis: pathophysiologic and therapeutic updates. Acta Derm Venereol. 2012; 92:7-15.
17) Buske-Kirschbaum A, Gierens A, Hollig H, Hellhammer DH. Stress-induced immunomodulation is altered in patients with atopic dermatitis. J of Neuroimmunol. 2002; 129:161-67.
18) Garg A, Chren M-M, Sands LP, Matsui MS, Marenus KD, Feingold KR, Elias PM. Psychological stress perturbs epidermal permeability barrier homeostasis. Arch Dermatol. 2001; 137:53-59.
19) Toh ZQ, Anzela A, Tang MLK, Licciardi PV. Probiotic therapy as a novel approach for allergic disease. Front in Pharm. 2012; 3(171):1-14.
20) Kalliomaki M, Salminen S, Poussa T, Isolauri E. Probiotics during the first 7 years of life: a cumulative risk reduction of eczema in a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2007; 119:1019-21.
21) Kukkonen K, Savilahti E, Haahtela T, Juntunen-Backman K, Korpela R, Poussa T, Tuure T, Kuitunen M. Probiotics and prebiotic galacto-oligosaccharides in the prevention of allergic diseases: a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2007; 119(1):192-198.
22) Kim JY, Kwon JH, Ahn SH, Lee SI, Han YS, Choi YO, Lee SY, Ahn KM, Ji GE. Effect of probiotic mix (Bifidobacterium bifidum, Bifidobacterium lactis, Lactobacillus acidophilus) in the primary prevention of eczema: a double-blind, randomized-control trial. Pediatr Allergy Immunol. 2010; 21(2Pt2):e386-e393.
23) Dotterud CK, Storro O, Johnsen R, Oien T. Probiotics in pregnant women to prevent allergic disease: a randomized, double-blind trial. Br J Dermatol. 2010; 163:616-23.
24) Niers LE, Timmerman HM, Rijkers GT, van Bleek GM, van Uden NO, Knol EF, Kapsenberg ML, Kimpen JL, Hoekstra MO. Identification of strong interleukin-10 inducing lactic acid bacteria which down-regulate T helper type 2 cytokines. Clin Exp Allergy. 2005; 35(11):1481-89.
25) Wickens K, Black PN, Stanley TV, Mitchell E, Fitzharris P, Tannock GW, Purdie G, Crane J, Probiotic Study Group. A differential effect of 2 probiotics in the prevention of eczema and atopy: a double-blind, randomized, placebo-controlled trial. J Allergy Clin Immunol. 2008; 122(4):788-794.
26) Foisy M, Boyle RJ, Chalmers JR, Simpson EL, Williams HC. The prevention of eczema in infants and children: an overview of Cochrane and non-Cochrane reviews. Evid Based Child Health. 2011;6(5):1322–39.
27) Doege K, Grajecki D, Zyriax BC, Detinkina E, Zu Eulenburg C, Buhling KJ. Impact of maternal supplementation with probiotics during pregnancy on atopic eczema in childhood- a meta-analysis. Br J Nutr. 2012; 107(1):1-6.
28) Bath-Hextall F, Delamere FM, Williams HC. Dietary exclusions for improving established atopic eczema in adults and children: systematic review. Allergy. 2009; 64:258-64.
29) Werfel T, Ballmer-Weber B, Eigenmann PA, Niggemann B, Rance F, Turjanmaa K, Worm M. Eczematous reactions to food in atopic eczema: position paper of the EAACI and GA2LEN. Allergy. 2007; 62(7):723-28.
30) Dhar S, Malakar R, Banerjee R, Chakraborty S, Chakraborty J, Mukherjee S. An uncontrolled open pilot study to assess the role of dietary eliminations in reducing the severity of atopic dermatitis in infants and children. Indian J Dermatol. 2009; 54(2): 183-185.
31) Celakovska J, Bukac J. Hypoallergenic diet can influence the severity of atopic dermatitis. Indian J Dermatol. 2013; 58(3):239-52.
32) Hong J, Buddenkotte J, Berger TG, Steinhoff M. Management of itch in atopic dermatitis. Semin Cutan Med Surg. 2011; 30(20): 71-86.
33) Januchowski R. Evaluation of topical vitamin B12 for the treatment of childhood eczema. J of Alt ad Comp Med. 2009; 15(4): 387-389.
34) Horrobin DF. Essential fatty acid metabolism and its modification in atopic eczema. Am J CLin Nutr. 2000; 71:3672-72s.
35) Hederos C-A, Berg A. Epogam evening primrose oil treatment in atopic dermatitis and asthma. Arch of Dis in Child. 1996; 75:494-97.
36) Javanbakht MA, Keshavarz SA, Djalali M, Siassi F, Eshraghian MR, Firooz A, Seirafi H, Ehsani AH, Chamari M, Mirshafiey A. Randomized controlled trial using vitamins E and D supplementation in atopic dermatitis. J of Derm Treat. 2011; 22(3):144-150.